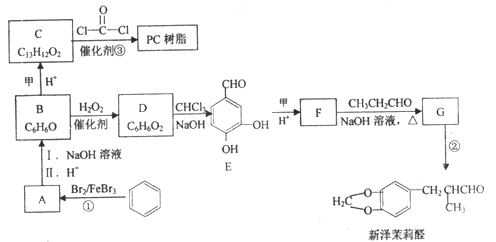
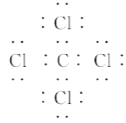
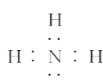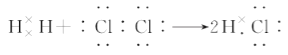题目内容
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下,下列说法不正确的是

A. NH4ClO4属于离子化合物
B. 溶解度: NaClO4> NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3—+H2O-2e-===C1O4—+2H+
D. 该流程中可循环利用的物质是NH4Cl
【答案】D
【解析】
由流程图可知,电解饱和食盐水用以制备NaClO3溶液,电解NaClO3溶液用以制备含有少量NaClO3的NaClO4溶液,除去NaClO3杂质后,向溶液中加入NH4Cl,反应生成NH4ClO4和NaCl,结晶得到NH4ClO4粗品和含有氯化钠的母液。
A项、NH4ClO4是由铵根离子和高氯酸根离子通过离子键形成的离子化合物,故A正确;
B项、由流程可知,高氯酸钠通过复分解反应制备高氯酸铵,并且可以采用结晶法分离高氯酸铵,所以,NH4ClO4的溶解度小于NaClO4、NaCl和NH4Cl,结晶时,会析出溶解度最小的NH4ClO4,故B正确;
C项、电解NaClO3溶液时,ClO3—离子在酸性条件下,在阳极放电生成C1O4—,电极反应式为ClO3—+H2O-2e-=C1O4—+2H+,故C正确;
D项、NaClO4溶液和NH4Cl反应生成NH4ClO4和NaCl,流程中可循环利用的物质是NaCl,故D错误。
故选D。

【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
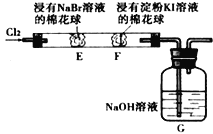
【题目】SO2与漂粉精是常用的漂白剂。某兴趣小组对它们的漂白原理进行探究。过程如下:
I. 探究SO2的漂白性
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中,观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a. 0.1 mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b. 0.1 mol/L NaHS03溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c. 0.1 mol/L Na2SO3溶液( pH=10) | 溶液立即褪色 | |
d. pH=10NaOH溶液 | 红色溶液不变色 | |
e. pH=2H2SO4溶液 | 红色溶液不变色 |
(1)实验d的目的是____________。
(2)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是____________。
(3)已知S02使品红溶液褪色过程是可逆的。兴趣小组继续试验:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
请用离子方程式和必要的文字说明出现上述现象的原因____________。
II. 探究SO2与漂粉精的反应
实验三:
操作 | 现象 |
| i. 液面上方出现白雾; ii. 稍后,出现浑浊,溶液变为黄绿色; iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
小组同学对上述现象进行探究:
(1)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(2)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是____________。
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀x中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是____________。
②用离子方程式解释现象iii中黄绿色褪去的原因________________。