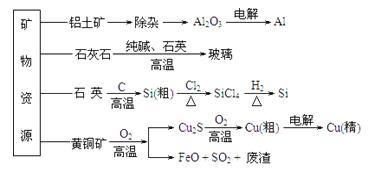
题目内容
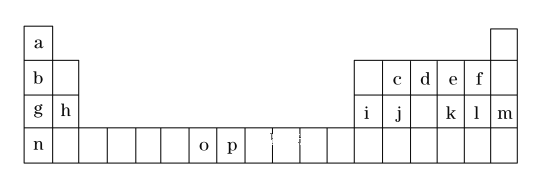
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
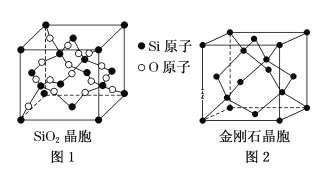
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
【答案】KOH HF ![]() 配位键 Si>Mg>Al>Na sp3 109°28′ 8 大于
配位键 Si>Mg>Al>Na sp3 109°28′ 8 大于 ![]()
【解析】
(一)根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;结合原子结构与性质分析解答;
(二)①SiO2晶胞中Si原子形成4个Si-O键,没有孤电子对,杂化轨道数目为4,形成S-O正四面体结构,据此分析解答;
②SiO2晶胞中,4个Si处于晶胞内部,另外原子处于晶胞顶点、面心,根据均摊法计算晶胞中Si原子数目;
③金刚石和晶体硅都是原子晶体,碳原子半径小于硅原子半径,则C-C共价键的键能大于Si-Si共价键的键能,据此分析判断;
④根据均摊法,计算一个金刚石晶胞中含有碳原子数,进而计算晶胞的质量和晶胞的体积,最后计算晶胞的密度。
(一)根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
①元素的金属性越强,最高价氧化物的水化物的碱性越强,碱性最强的是KOH;元素的非金属性越强,氢化物越稳定,稳定性最强的为HF,故答案为:KOH;HF;
②基态Mn原子的外围电子为其3d、4s电子,其外围电子排布图为 ,Fe3+离子与KSCN反应新生成的化学键为配位键,故答案为:
,Fe3+离子与KSCN反应新生成的化学键为配位键,故答案为: ;配位键;
;配位键;
③同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能Si>Mg>Al>Na,故答案为:Si>Mg>Al>Na;
(二)①SiO2晶胞中Si原子形成4个Si-O键,没有孤电子对,杂化轨道数目为4,Si原子采取sp3杂化,形成S-O正四面体结构,O-Si-O的键角为:109°28′,故答案为:sp3;109°28′;
②SiO2晶胞中,4个Si处于晶胞内部,另外原子处于晶胞顶点、面心,晶胞中Si原子数目=4+8×![]() +6×
+6×![]() =8,由化学式可知晶胞中O原子数目=8×2=16,故答案为:8;
=8,由化学式可知晶胞中O原子数目=8×2=16,故答案为:8;
③金刚石和晶体硅都是原子晶体,具有相似的结构,由于碳原子半径小于硅原子半径,则C-C共价键的键能大于Si-Si共价键的键能,因此熔点:金刚石>Si晶体,故答案为:大于;
④根据图示,一个金刚石晶胞中含有碳原子数=4+8×![]() 6×
6×![]() =8,则晶胞的质量=
=8,则晶胞的质量=![]() g,晶胞的体积为pm3=(a ×10-10)cm3,因此晶胞的密度=
g,晶胞的体积为pm3=(a ×10-10)cm3,因此晶胞的密度=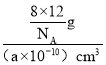 =
=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案