题目内容
【题目】“一碳化学”是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。发展“一碳化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“一碳化学”途径制取乙二醇的过程:
(1)在容积为2L的密闭容器中,由CO和H2合成乙醇的反应为
2CO(g)+ 4H2(g)![]() CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
CH3CH2OH(g)+ H2O(g),在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
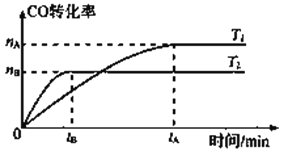
①根据上图可推知该反应ΔH_________0(填“>”、“<”或“=”)。
②该反应的平衡常数表达式为____________,降低温度平衡常数将_____(填“变大”、“变小”或“不变”)。
③下列说法中能判断该反应达到化学平衡状态的是_________(选填编号)。
a.容器中的压强不变 b.混合气体的密度不再变化
c.v正(CO)=2v逆(H2O) d.混合气体的平均相对分子质量不再变化
(2)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①用离子方程式解释KHC2O4溶液显酸性的原因:_______________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是________(填序号)。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>c(Na+)
(3)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式______________________________。以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为_____________。
【答案】 < K= ![]() 变大 a c d HC2O4-
变大 a c d HC2O4- ![]() H++C2O42-, HC2O4-+H2OH2C2O4+OH-,因为电离程度大于水解程度,所以呈酸性 a d CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol CH3OH+H2O-6e-=CO2+6H+
H++C2O42-, HC2O4-+H2OH2C2O4+OH-,因为电离程度大于水解程度,所以呈酸性 a d CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol CH3OH+H2O-6e-=CO2+6H+
【解析】(1)① 根据上图可知,T2达到平衡时间较短,反应速率较快,温度较高,T2条件下CO的转化率较T1的低,则温度越高,转化率越低,可推知对于反应2CO(g)+ 4H2(g) ![]() CH3CH2OH(g)+ H2O(g),升高温度,平衡向该反应逆反应方向移动,ΔH<0;②根据反应2CO(g)+ 4H2(g)
CH3CH2OH(g)+ H2O(g),升高温度,平衡向该反应逆反应方向移动,ΔH<0;②根据反应2CO(g)+ 4H2(g) ![]() CH3CH2OH(g)+ H2O(g)可得平衡常数表达式为K=
CH3CH2OH(g)+ H2O(g)可得平衡常数表达式为K=![]() ,降低温度,平衡向正反应方向移动,生成物的浓度增大,反应物的浓度降低,则平衡常数将变大;③a.该反应正反应方向为气体体积减小的方向,反应未达平衡时,容器中压强始终会变化,当压强不变时,说明反应到达平衡,选项a正确; b.反应在在容积为2L的密闭容器中,反应物都为气体,气体的总质量不变,容器的体积始终不变,则密度始终不变,不能说明反应到达平衡,选项b错误; c.根据反应可知,自始至终v正(CO)=2v正(H2O),若v正(CO)=2v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,选项c正确; d.该反应只有气体参加且正反应方向为气体体积减小的方向,根据M(平)=
,降低温度,平衡向正反应方向移动,生成物的浓度增大,反应物的浓度降低,则平衡常数将变大;③a.该反应正反应方向为气体体积减小的方向,反应未达平衡时,容器中压强始终会变化,当压强不变时,说明反应到达平衡,选项a正确; b.反应在在容积为2L的密闭容器中,反应物都为气体,气体的总质量不变,容器的体积始终不变,则密度始终不变,不能说明反应到达平衡,选项b错误; c.根据反应可知,自始至终v正(CO)=2v正(H2O),若v正(CO)=2v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,选项c正确; d.该反应只有气体参加且正反应方向为气体体积减小的方向,根据M(平)=![]() ,反应未达平衡时,混合气体的平均相对分子质量不始终变化,混合气体的平均相对分子质量不变,则说明反应到达平衡状态,选项d错误;答案选:acd;(2) ①KHC2O4溶液中存在电离平衡:HC2O4-
,反应未达平衡时,混合气体的平均相对分子质量不始终变化,混合气体的平均相对分子质量不变,则说明反应到达平衡状态,选项d错误;答案选:acd;(2) ①KHC2O4溶液中存在电离平衡:HC2O4- ![]() H++C2O42-, 水解平衡:HC2O4-+H2OH2C2O4+OH-,溶液显酸性表明它的电离程度大于水解程度,所以呈酸性;②a.根据物料守恒可得c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),选项a正确; b.根据电荷守恒可得c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),选项b错误;c.由物料守恒:c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),电荷守恒:c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),由电荷守恒式子减去物料守恒式子可得:c(Na+) = c(C2O42-) -c(H2C2O4) ,选项c错误;d.若加入的NaOH与KHC2O4恰好反应c(K+) = c(Na+)。此时溶液呈碱性,故加入的NaOH的物质的量要比KHC2O4少,所以c(K+) > c(Na+),选项d正确。答案选ad;(5)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,则CH3OH(l)的燃烧热为677kJ/mol-27kJ/mol=650 kJ/mol,故CH3OH(l)完全燃烧的热化学方程式为:CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol;总反应式为2CH3OH+3O2(g)=2CO2(g)+4H2O,正极是还原反应,氧气在正极放电,酸性条件下获得电子生成水,正极电极反应式为:3O2+12H++12e-=6H2O,总反应式减去正极反应式可得负极电极反应式为:2CH3OH+2H2O-12e-=2CO2+12H+,即CH3OH+H2O-6e-=CO2+6H+。
H++C2O42-, 水解平衡:HC2O4-+H2OH2C2O4+OH-,溶液显酸性表明它的电离程度大于水解程度,所以呈酸性;②a.根据物料守恒可得c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),选项a正确; b.根据电荷守恒可得c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),选项b错误;c.由物料守恒:c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-),电荷守恒:c(K+) + c(Na+) = c(HC2O4-) +2 c(C2O42-),由电荷守恒式子减去物料守恒式子可得:c(Na+) = c(C2O42-) -c(H2C2O4) ,选项c错误;d.若加入的NaOH与KHC2O4恰好反应c(K+) = c(Na+)。此时溶液呈碱性,故加入的NaOH的物质的量要比KHC2O4少,所以c(K+) > c(Na+),选项d正确。答案选ad;(5)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,则CH3OH(l)的燃烧热为677kJ/mol-27kJ/mol=650 kJ/mol,故CH3OH(l)完全燃烧的热化学方程式为:CH3OH(l)+ 2 O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol;总反应式为2CH3OH+3O2(g)=2CO2(g)+4H2O,正极是还原反应,氧气在正极放电,酸性条件下获得电子生成水,正极电极反应式为:3O2+12H++12e-=6H2O,总反应式减去正极反应式可得负极电极反应式为:2CH3OH+2H2O-12e-=2CO2+12H+,即CH3OH+H2O-6e-=CO2+6H+。

【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c (NO2) | c (NO) | c (O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B. 达平衡时,容器Ⅱ中c(O2)/ c(NO2)比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为T2时,若k正=k逆,则T2>T1