题目内容
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】_________________________________(用离子方程式表示)
【实验内容及记录】

请回答:
(1)根据上表中的实验数据,可以得到的结论是_______________。
(2)利用实验1中数据计算,用H2C2O4的浓度变化表示的反应速率v(H2C2O4)=________。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
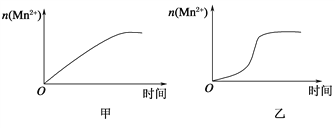
①该小组同学提出的假设是_______________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。__________

③若该小组同学提出的假设成立,应观察到的现象是____________________。
【答案】 2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O 其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大 3.75×10-2 mol·L-1·min-1 生成物中的MnSO4为该反应的催化剂[或Mn2+对该反应有催化作用] MnSO4 与实验1比较,溶液褪色所需时间短[或所用时间(t)小于4 min]
【解析】本题主要考查对于“外界条件对化学反应速率的影响”探究实验的评价。
【实验原理】2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大。
(2)v(H2C2O4)=5v(KMnO4)/2=5/2×0.2×3.0×10-3/4.0 mol·L-1·min-1=3.75×10-2 mol·L-1·min-1。
(3)①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂[或Mn2+对该反应有催化作用]。
②表中空白填写:MnSO4。
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短[或所用时间(t)小于4 min]。