题目内容
【题目】下列有关电解质溶液的说法正确的是
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO3)的比值将减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中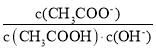 增大
增大
C.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>④>②>③
D.常温下将pH=2的盐酸与pH=13的Ba(OH)2溶液混合后,所得溶液的pH=11,则盐酸与Ba(OH)2溶液的体积比为9:1
【答案】D
【解析】
A.加水稀释,促进阴离子的水解,NaHCO3溶液中加水,c(Na+)与c(HCO3-)的比值将增大,A错误;
B.![]() =
=![]() ,温度升高醋酸钠的水解常数增大,整个分式值减小,B错误;
,温度升高醋酸钠的水解常数增大,整个分式值减小,B错误;
C.相同浓度的这几种溶液中,一水合氨是弱电解质,铵根离子浓度最小、醋酸根离子促进铵根离子水解、铝离子抑制铵根离子水解,所以铵根离子浓度大小顺序是:①>②>④>③,C错误;
D.设盐酸中氢离子浓度为c1,体积为V1,氢氧化钡中氢氧根浓度为c2,体积为V2,二者混合后溶液呈碱性,说明碱剩余,故可列式子c=![]() ,将c1=10-2mol/L,c2=10-1mol/L带入,解得V1:V2=9:1,D正确;
,将c1=10-2mol/L,c2=10-1mol/L带入,解得V1:V2=9:1,D正确;
故选D。

 阅读快车系列答案
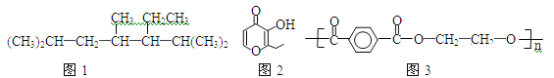
阅读快车系列答案【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
![]()
![]()
![]() +
+ +
+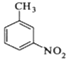
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是___________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或'下”)。
(3)5% NaHCO3溶液洗涤的目的是__________
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂)/n(甲苯) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为_______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_____________。
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化