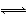
题目内容
某温度下 ,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
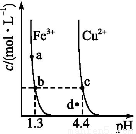
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
B
【解析】b、c两点金属阳离子的浓度相等,都设为x,设该温度为室温,则c(OH-)c=10-9.6 mol·L-1,c(OH-)b=10-12.7 mol·L-1,则Ksp[Fe(OH)3]=x×(10-12.7)3,Ksp[Cu(OH)2]=x×(10-9.6)2,故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],A正确;a点到b点的碱性增强,而NH4Cl溶解于水后显酸性,故B错;只要温度一定,KW就一定,故C正确;溶度积曲线上的点代表的溶液都已饱和,曲线左下方的点都不饱和,右上方的点都是Qc>Ksp,沉淀要析出,故D正确。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目