题目内容
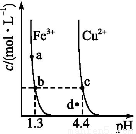
化学反应N2+3H2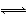 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(g) ΔH=2(b-a)kJ·mol-1
2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g) NH3(l) ΔH=(b+c-a)kJ·mol-1
NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g) NH3(g) ΔH=(a+b)kJ·mol-1
NH3(g) ΔH=(a+b)kJ·mol-1
A
【解析】由图示可知:(1)断裂 mol N2(g)和mol H2(g)中的化学键共吸收a kJ的能量,由1 mol N和3 mol H生成1 mol NH3(g)放出b kJ的能量,由1 mol NH3(g)变为1 mol NH3(l)放出c kJ能量;(2)由mol N2(g)和mol H2(g)生成1 mol NH3(g)或1 mol NH3(l)均放出能量。故有①N2(g)+H2(g)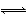 NH3(g) ΔH=-(b-a)kJ·mol-1=(a-b)kJ·mol-1或②N2(g)+H2(g)
NH3(g) ΔH=-(b-a)kJ·mol-1=(a-b)kJ·mol-1或②N2(g)+H2(g) NH3(l) ΔH=-(b+c-a)kJ·mol-1=(a-b-c)kJ·mol-1,因此C、D项均错误。将①式乘以2得:N2(g)+3H2(g)
NH3(l) ΔH=-(b+c-a)kJ·mol-1=(a-b-c)kJ·mol-1,因此C、D项均错误。将①式乘以2得:N2(g)+3H2(g) 2NH3(g) ΔH=2(a-b)kJ·mol-1,B项错误;将②式乘以2得:N2(g)+3H2(g)
2NH3(g) ΔH=2(a-b)kJ·mol-1,B项错误;将②式乘以2得:N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1,A项正确。
2NH3(l) ΔH=2(a-b-c)kJ·mol-1,A项正确。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 |
| 1 |
|
2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol |
|
| 0.8 |
|
已知2 min内v(Q)=0.075 mol·L-1·min-1,,
(1)试确定以下物质的相关量:
起始时n(Y)= ,n(Q)= 。
(2)方程式中m= ,n= ,p= ,q= 。
(3)用Z表示2 min内的反应速率 。