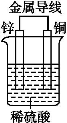
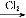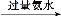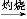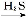题目内容
(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
(1)13
(2)< N+H2O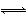 NH3·H2O+H+
NH3·H2O+H+
(3)C
【解析】0.1 mol·L-1 NaOH溶液的c(OH-)=0.1 mol·L-1,c(H+)= mol·L-1=10-13 mol·L-1,pH=-lg[c(H+)]=13;由于N能结合水电离出来的OH-生成弱电解质NH3·H2O,破坏了水的电离平衡,使溶液显酸性;将两种溶液等体积混合,发生反应:NaOH+NH4Cl NaCl+NH3·H2O,Na+和Cl-均不水解,浓度相等,NH3·H2O能电离出OH-,使c(OH-)>c(H+)。
NaCl+NH3·H2O,Na+和Cl-均不水解,浓度相等,NH3·H2O能电离出OH-,使c(OH-)>c(H+)。

练习册系列答案
相关题目