题目内容
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.64 g铜丝加热下在足量硫黄蒸气里完全反应后,失去的电子数为NA
B.0.2 mol NO和0.1 mol O2充分反应后,混合物的分子数为0.2NA
C.1 mol SO2溶于足量水,溶液中H2SO3、HSO3-与SO32-粒子的物质的量之和为NA
D.l00g质量分数为46%的乙醇水溶液中氧原子数为NA
【答案】A
【解析】
A.铜和硫生成硫化亚铜,1mol铜转移1mol电子,即![]() 个,A正确;
个,A正确;
B.0.2 mol![]() 和0.1 mol
和0.1 mol![]() 会生成0.2mol
会生成0.2mol![]() ,但是一部分
,但是一部分![]() 会反应生成
会反应生成![]() ,所以分子数小于0.2
,所以分子数小于0.2![]() ,B错误;
,B错误;
C.![]() 和水的反应为可逆反应,故溶液中还存在
和水的反应为可逆反应,故溶液中还存在![]() 分子,溶液中
分子,溶液中![]() 粒子的物质的量之和小于
粒子的物质的量之和小于![]() ,C错误;
,C错误;
D.l00g质量分数为46%的乙醇水溶液中,乙醇为46g,乙醇含氧原子为1mol,溶液中还有大量的水,水中同样含有氧原子,故氧原子数大于![]() ,D错误;
,D错误;
故答案选A。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
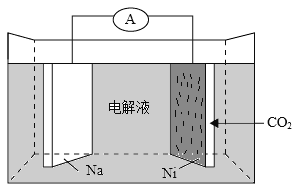
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如 所示,1183 K以上转变为
所示,1183 K以上转变为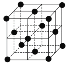 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。