题目内容
分别用X、Y、Z、W四种金属进行如下三个实验:
|
分析:1、在原电池中,负极金属易被腐蚀,正极金属不易被腐蚀;
2、金属的活泼性越强,则和酸反应生成气体越剧烈;
3、电解池中,在阴极上氧化性强的离子先得到电子,离子的得电子能力越强,金属单质的还原性越弱.
2、金属的活泼性越强,则和酸反应生成气体越剧烈;
3、电解池中,在阴极上氧化性强的离子先得到电子,离子的得电子能力越强,金属单质的还原性越弱.
解答:解:根据1可知金属活泼性是:X>Y,根据2可知金属的活泼性是:W>X,根据3可知,金属的活泼性是Y>Z,所以四种金属的金属活动性为:W>X>Y>Z,Z可能是Ag或Cu.
A、金属单质的还原性越弱,离子的得电子能力越强,即氧化性越强,四种金属的金属活动性为:W>X>Y>Z,所以Z的阳离子氧化性最强,故A正确;
B、金属的活动性为:W>Y,W的还原性强于Y的还原性,故B正确;
C、四种金属的金属活动性为:W>X>Y>Z,Z可能是Ag或Cu,Z放入CuSO4溶液中一定没有Cu析出,故C错误;
D、金属活泼性是:X>Z,所以用X、Z和稀硫酸构成的原电池,X做负极,故D正确.
故选C.
A、金属单质的还原性越弱,离子的得电子能力越强,即氧化性越强,四种金属的金属活动性为:W>X>Y>Z,所以Z的阳离子氧化性最强,故A正确;
B、金属的活动性为:W>Y,W的还原性强于Y的还原性,故B正确;
C、四种金属的金属活动性为:W>X>Y>Z,Z可能是Ag或Cu,Z放入CuSO4溶液中一定没有Cu析出,故C错误;
D、金属活泼性是:X>Z,所以用X、Z和稀硫酸构成的原电池,X做负极,故D正确.
故选C.
点评:本题考查学生金属活动顺序表的应用知识,可以根据教材知识来回答,难度不大,注意平时知识的积累是解题的关键.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
分别用X、Y、Z、W四种金属进行如下三个实验:
根据以上事实的下列判断错误的是( )
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 2 | 将X、W分别投入等浓度的稀盐酸中都有气体产生,但W比X反应剧烈 |
| 3 | 用惰性电极电解含等物质的量浓度的Y2+和Z2+混合溶液,在阴极上首先析出单质Z |
| A、Z2+的氧化性可能最强 |
| B、W的金属活动性强于Y |
| C、Z放入CuSO4溶液中一定有Cu析出 |
| D、用X、Z和稀硫酸构成的原电池,X做负极 |
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下: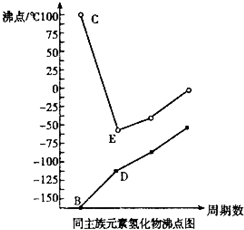 X、Y、Z、W是原子序数依次增大的四种短周期元素,X和Z,Y和W分别同主族.B、C、D、E分别为X、Y、Z、W的氢化物,它们的沸点如图
X、Y、Z、W是原子序数依次增大的四种短周期元素,X和Z,Y和W分别同主族.B、C、D、E分别为X、Y、Z、W的氢化物,它们的沸点如图 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) ="0.1" mol /L ; c (Z)="1.6" mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________ ____, a的取值范围为_______________