题目内容
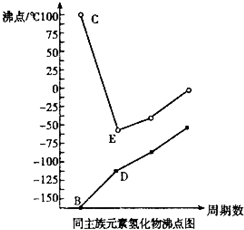 X、Y、Z、W是原子序数依次增大的四种短周期元素,X和Z,Y和W分别同主族.B、C、D、E分别为X、Y、Z、W的氢化物,它们的沸点如图
X、Y、Z、W是原子序数依次增大的四种短周期元素,X和Z,Y和W分别同主族.B、C、D、E分别为X、Y、Z、W的氢化物,它们的沸点如图(1)元素Z、W的名称:Z
(2)比较元素X、W的非金属性强弱(用元素符合回答)
(3)C的沸点反常的原因是
(4)由元素X、Y、Z形成的两种化合物ZX、ZY2具有相同的晶体类型,都属于
分析:X、Y、Z、W是原子序数依次增大的四种短周期元素,Y的氢化物C的沸点为100℃,则C为H2O,故Y为氧元素,Y和W同主族,则W为硫元素,其氢化物E为H2S.X和Z同主族,其对应的氢化物沸点增大,则X氢化物中不含氢键,原子序数小于氧元素,则X为碳元素,则Z为硅元素,据此解答.
解答:解:X、Y、Z、W是原子序数依次增大的四种短周期元素,Y的氢化物C的沸点为100℃,则C为H2O,故Y为氧元素,Y和W同主族,则W为硫元素,其氢化物E为H2S.X和Z同主族,其对应的氢化物沸点增大,则X氢化物中不含氢键,原子序数小于氧元素,则X为碳元素,则Z为硅元素,
(1)由上述分析可知:Z为硅,W为硫,故答案为:硅;硫;
(2)碳酸为弱酸,硫酸为强酸,故非金属性强弱为C<S,故答案为:C<S;
(3)水分子之间可形成氢键,增强了分子之间的作用力,沸点高于同主族其它元素氢化物.Cl2通入水中发生反应的离子方程式是Cl2+H2O=H++Cl-+HClO,
故答案为:水分子之间可形成氢键,增强了分子之间的作用力;Cl2+H2O=H++Cl-+HClO;
(4)化合物ZX为SiC,化合物ZY2为SiO2,二者具有相同的晶体类型,都属于原子晶体,化合物SiC在加热时和足量的氧气反应可生成SiO2,同时生成CO2,反应的化学方程式为:SiC+2O2
SiO2+CO2,
故答案为:原子;SiC+2O2
SiO2+CO2.
(1)由上述分析可知:Z为硅,W为硫,故答案为:硅;硫;
(2)碳酸为弱酸,硫酸为强酸,故非金属性强弱为C<S,故答案为:C<S;
(3)水分子之间可形成氢键,增强了分子之间的作用力,沸点高于同主族其它元素氢化物.Cl2通入水中发生反应的离子方程式是Cl2+H2O=H++Cl-+HClO,
故答案为:水分子之间可形成氢键,增强了分子之间的作用力;Cl2+H2O=H++Cl-+HClO;
(4)化合物ZX为SiC,化合物ZY2为SiO2,二者具有相同的晶体类型,都属于原子晶体,化合物SiC在加热时和足量的氧气反应可生成SiO2,同时生成CO2,反应的化学方程式为:SiC+2O2
| ||
故答案为:原子;SiC+2O2
| ||
点评:本题考查结构性质位置关系的应用,根据氢化物沸点确定元素是解题根据,水的沸点为突破口,难度不大.

练习册系列答案
相关题目

