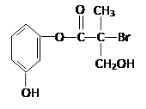
题目内容
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
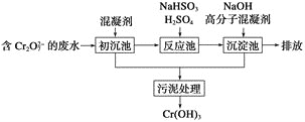
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
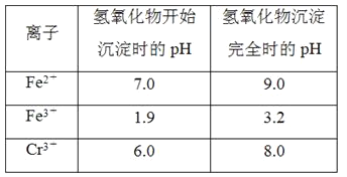
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
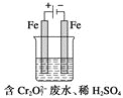
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
【答案】Al3++3H2O===Al(OH)3(胶体)+3H+[或Al3++3H2O![]() Al(OH)3(胶体)+3H+] Cr3++3OH-===Cr(OH)3↓ H++OH-===H2O 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全 Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O 8.48
Al(OH)3(胶体)+3H+] Cr3++3OH-===Cr(OH)3↓ H++OH-===H2O 测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全 Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O 8.48
【解析】
(1)①氢氧化铝胶体能吸附悬浮物,所以作混凝剂;
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,反应后溶液中有H+、Cr3+,加NaOH溶液,NaOH会和H+、Cr3+发生反应;
(2)Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子;随着电解进行,溶液中c(H+)逐渐减少,c(OH-)浓度增大;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓进行计算。
(1)①K2SO4﹒Al2(SO4)3﹒24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2OAl(OH)3+3H+,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物,所以能作净水剂,
故答案为:Al3++3H2O===Al(OH)3(胶体)+3H+[或Al3++3H2O![]() Al(OH)3(胶体)+3H+] ;
Al(OH)3(胶体)+3H+] ;
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,反应后溶液中有H+、Cr3+;根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,根据题给图表信息可知,Cr(OH)3沉淀完全时的pH为8,所以,测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-═Cr(OH)3↓、H++OH-═H2O;测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全;
(2)亚铁离子与Cr2O72-发生氧化还原反应,被还原为Cr3+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;随着电解进行,溶液中c(H+)逐渐减少,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强,生成Fe(OH)3和Cr(OH)3沉淀,金属阳离子在阴极区可沉淀完全;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01molCr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,至少得到沉淀的质量是0.02mol×103g/mol+0.06mol×107g/mol=8.48g;
故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O; 8.48。