题目内容
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
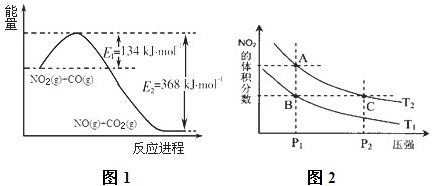
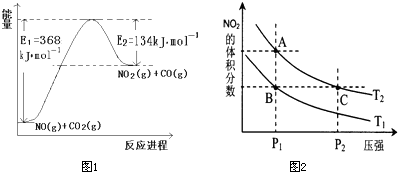
(1)根据右侧能量变化示意图1,请写出NO2和CO反应的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,
其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K=
②试判断K1
③下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法.

(1)根据右侧能量变化示意图1,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1
.(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
>
>
K2(填写“>”,“=”或“<”)③下列各项能说明该反应已达到平衡状态的是
c
c
(填字母)a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是
CD
CD
.a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法.
分析:(1)根据能量变化图,反应热等于正反应的活化能减去逆反应的活化能;
(2)①依据平衡常数等于平衡生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
②根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(3)a.A、C两点都在等温线上,压强越大,反应速率越快;
b.A、C两点都在等温线上,平衡常数只与温度有关;
c.A、C两点都在等温线上,压强增大,平衡向气体体积减少的方向移动;
d.该反应为吸热反应,升高温度平衡向逆反应方向移动;
(3)依据化学平衡三段式列式计算,利用转化率、反应速率概念的含义计算.
(2)①依据平衡常数等于平衡生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
②根据升高温度平衡吸热方向移动以及平衡逆向移动平衡常数减小;
③直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(3)a.A、C两点都在等温线上,压强越大,反应速率越快;
b.A、C两点都在等温线上,平衡常数只与温度有关;
c.A、C两点都在等温线上,压强增大,平衡向气体体积减少的方向移动;
d.该反应为吸热反应,升高温度平衡向逆反应方向移动;
(3)依据化学平衡三段式列式计算,利用转化率、反应速率概念的含义计算.
解答:解:(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)①N2(g)+3H2(g)?2NH3(g)△H<0,平衡常数计算表达式k=
,故答案为:
;
②N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选:c;
(3)A.A、C两点都在等温线上,压强越大,反应速率越快,所以速率:C>A,故A错误;
B.A、C两点都在等温线上,平衡常数只与温度有关,所以化学平衡常数:A=C,故B错误;
C.A、C两点都在等温线上,C点压强更高,压强增大,平衡向气体体积减少的方向移动,即逆反应方向移动,N2O4的转化率降低,所以两点N2O4的转化率:A>C,故C正确;
D.该反应为吸热反应,升高温度平衡向正反应方向移动,NO2的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
故选:CD.
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ?mol-1;
(2)①N2(g)+3H2(g)?2NH3(g)△H<0,平衡常数计算表达式k=
| c2(NH3) |
| c(N2)×c3(H2) |
| c2(NH3) |
| c(N2)×c3(H2) |
②N2(g)+3H2(g)?2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2,故答案为:>;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选:c;
(3)A.A、C两点都在等温线上,压强越大,反应速率越快,所以速率:C>A,故A错误;
B.A、C两点都在等温线上,平衡常数只与温度有关,所以化学平衡常数:A=C,故B错误;
C.A、C两点都在等温线上,C点压强更高,压强增大,平衡向气体体积减少的方向移动,即逆反应方向移动,N2O4的转化率降低,所以两点N2O4的转化率:A>C,故C正确;
D.该反应为吸热反应,升高温度平衡向正反应方向移动,NO2的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
故选:CD.
点评:本题主要考查了热化学方程式的书写、化学平衡常数、化学平衡的图象、平衡状态的判断等,题目难度中等,侧重对学生能力的考查.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.