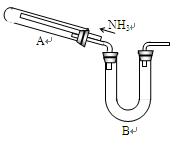
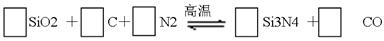题目内容
(6分)、将22.4g铜与92ml一定浓度的硝酸反应,铜完全溶解,,产生的NO和NO2混合气体在标准状况下的体积为6.72L。
(1)求NO、NO2的体积分别是多少?
(2)若要将产生的NO、NO2气体用水完全吸收,则需O2的体积(标准状况下)是多少?
(1)求NO、NO2的体积分别是多少?
(2)若要将产生的NO、NO2气体用水完全吸收,则需O2的体积(标准状况下)是多少?
(6分)、(1)Cu+4HNO3(浓)=Cu(NO3)2+2 NO2↑+2H2O 1分
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 1分
(2)V (NO2)="2.24L " V (NO)="4.48L " 每个1分
(3)V (O2)="3.92L " 2分
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 1分
(2)V (NO2)="2.24L " V (NO)="4.48L " 每个1分
(3)V (O2)="3.92L " 2分
略

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目

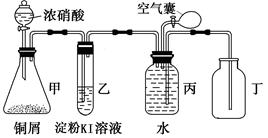
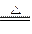 3Cu + N2 +3H2O
3Cu + N2 +3H2O