题目内容
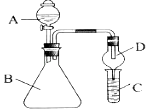
【题目】关于以下装置的描述正确的是( )

A. 乙装置工作时, CuSO4溶液中可能出现K+,ZnSO4溶液中可能出现Cl-
B. 甲、乙的电路中各转移 1 mol电子时,溶液中各生成1 mol ZnSO4
C. 取出盐桥,灯泡仍可发光
D. 甲、乙两装置中的总反应式不可能相同
【答案】A
【解析】A. 乙装置工作时构成原电池,铜为正极,锌为负极,盐桥中的离子定向移动,其中K+移向CuSO4溶液,Cl-移向ZnSO4溶液,故A正确;B. 甲、乙工作时均构成原电池,电路中各转移 1 mol电子时,溶解0.5mol锌,溶液中各生成0.5mol ZnSO4,故B错误;C. 取出盐桥,甲不能构成原电池,灯泡不能发光,故C错误;D. 甲、乙两装置中的总反应式相同,均发生锌与硫酸铜的置换反应,故D错误;故选A。

练习册系列答案
相关题目
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大