题目内容
【题目】利用如图装置可验证同主族元素非金属性的变化规律 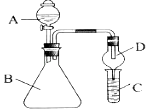
(1)仪器A的名称为 , 干燥管D的作用是 .
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加(填名称),C中加淀粉﹣碘化钾溶液,观察到C中溶液的现象,即可证明.从环境保护的观点,此装置的不足之处是 .
(3)若要证明非金属性:C>Si,则在A中加盐酸,B中加CaCO3 , C中加(填试剂)即可证明.乙同学认为此方案有不足之处,应在B、D两装置间加装有(填试剂)的洗气瓶.
【答案】
(1)分液漏斗;防倒吸
(2)高锰酸钾、氯酸钾、次氯酸盐均可;变蓝;缺少尾气处理装置
(3)NaSiO3溶液;饱和NaHCO3溶液
【解析】解:(1)仪器A具有球形特征的漏斗且带有玻璃活塞,该仪器名称是分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,所以答案是:分液漏斗;防倒吸;
(2.)若要证明非金属性:Cl>I,则A中加浓盐酸,浓盐酸和酸性高锰酸钾溶液反应生成氯气,2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,所以B中加高锰酸钾,也可用氯酸钾、次氯酸盐,氯气能氧化碘离子生成碘Cl2+2I﹣=I2+2Cl﹣ , 碘遇淀粉变蓝,验证非金属性Cl>I,所以看到的现象是溶液变蓝色;氯气有毒,不能直接排空,能和水反应生成酸,可以用碱液NaOH处理尾气,所以此装置的不足之处是缺少尾气处理装置,所以答案是:高锰酸钾、氯酸钾、次氯酸盐均可;变蓝;缺少尾气处理装置;
(3.)在A中加盐酸,B中加CaCO3 , 根据强酸制弱酸原理,碳酸钙与盐酸反应生成二氧化碳:CaCO3+2HCl═CaCl2+CO2↑+H2O,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,若要证明非金属性:C>Si,C中需放硅的最高价氧化物对应的酸硅酸的盐,所以C中放硅酸钠,在C中通入二氧化碳气体生成硅酸沉淀,反应的方程式为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3 , 说明碳酸酸性比硅酸强,从而说明非金属性:C>Si,因为盐酸的挥发性导致生成的二氧化碳中含有盐酸,盐酸和硅酸钠反应干扰二氧化碳的检验,应该用饱和碳酸氢钠溶液除去盐酸,
所以答案是:NaSiO3溶液; 饱和NaHCO3溶液.

【题目】在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() B(g)+C(g) △H =+85.1kJ/mol 反应时间(t)与容器内总压强(P)的数据见下表:
B(g)+C(g) △H =+85.1kJ/mol 反应时间(t)与容器内总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
计算平衡时A的转化率__________和平衡常数___________________。

