题目内容
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为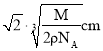
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
【答案】D
【解析】
A. 金刚石、SiC属于原子晶体,键长![]() ,故金刚石中化学键更稳定,其熔点更高,NaF、NaCl都属于离子晶体,氟离子半径小于氯离子比较,故NaF的晶格能大于NaCl,则NaF的熔点更高,H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高,熔点原子晶体
,故金刚石中化学键更稳定,其熔点更高,NaF、NaCl都属于离子晶体,氟离子半径小于氯离子比较,故NaF的晶格能大于NaCl,则NaF的熔点更高,H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高,熔点原子晶体![]() 离子晶体
离子晶体![]() 分子晶体,故金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故A正确;
分子晶体,故金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故A正确;
B. CaO晶体结构与NaCl晶体结构相似,氯化钠的晶胞图为 ,若Ca2+处于体心、棱中间,O2-位于面心、顶点,晶体中体心Ca2+与面心的6个O2-距离最近,Ca2+配位数为6,且这些最邻近的O2-围成正八面体,故B正确;
,若Ca2+处于体心、棱中间,O2-位于面心、顶点,晶体中体心Ca2+与面心的6个O2-距离最近,Ca2+配位数为6,且这些最邻近的O2-围成正八面体,故B正确;
C. 氯化钠的晶胞图为 ,假设绿色球为Cl-,处于面对角线上的Cl-之间距离最近,设二者距离为
,假设绿色球为Cl-,处于面对角线上的Cl-之间距离最近,设二者距离为![]() ,则晶胞棱长
,则晶胞棱长![]() ,晶胞体积
,晶胞体积![]() ,晶胞中Cl-数目
,晶胞中Cl-数目![]() ,晶胞中Na+数目也是4,晶胞质量
,晶胞中Na+数目也是4,晶胞质量![]() ,解得
,解得![]()
 ,故C正确;
,故C正确;
D.处于棱的中心的原子为4个晶胞共用,位于顶角的原子为8个晶胞共用,晶胞中X数目![]() ,Y数目
,Y数目![]() ,则该晶体的组成式为
,则该晶体的组成式为![]() ,故D错误,
,故D错误,
答案选D。

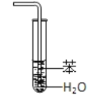
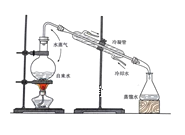
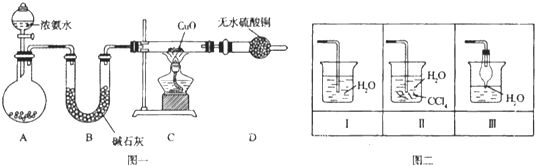
【题目】实验是化学研究的基础,关于下列各实验装置图的叙述正确的是( )
|
|
|
|
① | ② | ③ | ④ |
A.装置①中溶液上层无色,下层紫红色B.装置②可用于吸收HCl气体,并防止倒吸
C.装置③可用于制取蒸馏水D.装置④中液体蒸干后停止加热
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行