题目内容
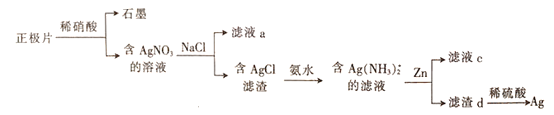
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+=Cu+Cu2++H2O)。

(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为____________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
【答案】Fe2+ 2Fe3++Cu=2Fe2++Cu2+ 氯水和KSCN溶液(或双氧水和KSCN溶液等,合理即可) 2Al+Fe2O3![]() Al2O3+2Fe ac 灼烧,冷却至室温后称重,重复多次 坩埚 SiO2+2OH=SiO32+H2O
Al2O3+2Fe ac 灼烧,冷却至室温后称重,重复多次 坩埚 SiO2+2OH=SiO32+H2O
【解析】
向铜矿石中加足量稀盐酸发生的反应有:Al2O3+6HCl=2AlCl3+3H2O,Fe2O3+6HCl=2FeCl3+3H2O,Cu2O+2HCl=Cu+CuCl2+H2O, 2FeCl3+Cu=2FeCl2+CuCl2 ,因Cu2O是大量的,FeCl3完全转化为FeCl2。因此,固体混合物B的主要成分是Cu和SiO2,滤液A主要是CuCl2、AlCl3、FeCl2、HCl等混合溶液。滤液A中加足量NaOH溶液有反应:AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,CuCl2+2NaOH=Cu(OH)2↓+2NaCl,FeCl2+2NaOH =Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以固体混合物D主要是Fe(OH)3和Cu(OH)2。D在空气中灼烧而分解2Fe(OH)3![]() Fe2O3+3H2O,Cu(OH)2
Fe2O3+3H2O,Cu(OH)2![]() CuO+H2O,故固体F是Fe2O3和CuO。滤液C主要是NaAlO2和NaCl溶液、NaOH溶液,根据“金属单质E+固体混合物F
CuO+H2O,故固体F是Fe2O3和CuO。滤液C主要是NaAlO2和NaCl溶液、NaOH溶液,根据“金属单质E+固体混合物F![]() 粗铜”可知金属单质E是铝。由“固体混合物B
粗铜”可知金属单质E是铝。由“固体混合物B![]() 粗铜”可知,加入溶液G是为了除去SiO2,显然溶液G可选用NaOH溶液:SiO2+2NaOH=Na2SiO3+H2O。金属Al分别与Fe2O3和CuO高温下发生铝热反应:Fe2O3+2Al
粗铜”可知,加入溶液G是为了除去SiO2,显然溶液G可选用NaOH溶液:SiO2+2NaOH=Na2SiO3+H2O。金属Al分别与Fe2O3和CuO高温下发生铝热反应:Fe2O3+2Al![]() 2Fe+Al2O3,3CuO+2Al
2Fe+Al2O3,3CuO+2Al![]() 3Cu+Al2O3,最后将粗铜作阳极电解精炼制得精铜。
3Cu+Al2O3,最后将粗铜作阳极电解精炼制得精铜。
(1)因为铜矿石中Cu2O是过量的,在稀盐酸中Cu2O+2HCl=Cu+CuCl2+H2O,生成的Cu能将溶液中FeCl3完全转化为FeCl2:2FeCl3+Cu=2FeCl2+CuCl2,向滤液A中先加KSCN溶液,溶液不变红色,排除了Fe3+存在,再加入氯水(或双氧水)后溶液变红色,可检验该溶液中含有Fe2+。所以滤液A中铁元素的存在形式为Fe2+。生成Fe2+的离子方程式为2Fe3++Cu=2Fe2++Cu2+,检验滤液A中存在Fe2+的试剂为KSCN溶液和氯水(或KSCN溶液和双氧水溶液);
(2)金属E是铝单质,固体F是Fe2O3和CuO的混合物,其中铝与Fe2O3在高温下反应可用于焊接钢轨,该反应的化学方程式为Fe2O3+2Al![]() 2Fe+Al2O3;因该反应是放热反应,且活化能较高,故需要高温引燃,KClO3和Mg作为引燃剂,答案选ac;
2Fe+Al2O3;因该反应是放热反应,且活化能较高,故需要高温引燃,KClO3和Mg作为引燃剂,答案选ac;
(3)固体混合物D中Fe(OH)3和Cu(OH)2空气中灼烧发生反应:2Fe(OH)3![]() Fe2O3+3H2O,Cu(OH)2
Fe2O3+3H2O,Cu(OH)2![]() CuO+H2O,若使之完全分解,应在坩埚中灼烧,冷却至室温后称重,重复多次,直至连续两次称量的结果相同且质量相差小于0.1g时为止;固体灼烧必须用到的实验仪器是坩埚;
CuO+H2O,若使之完全分解,应在坩埚中灼烧,冷却至室温后称重,重复多次,直至连续两次称量的结果相同且质量相差小于0.1g时为止;固体灼烧必须用到的实验仪器是坩埚;
(4)从流程图上看,固体混合物B中含有SiO2和Cu,加入溶液G是为了回收混合物B中的Cu,溶液G如果是NaOH溶液,即可将SiO2转化为易溶于水的Na2SiO3,再过滤即可得到Cu,其反应的离子方程式为SiO2+2OH-=SiO32-+H2O。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案