题目内容
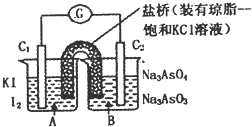
【题目】钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将![]() 和
和![]() 转化成难溶弱酸盐。
转化成难溶弱酸盐。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)将SrSO4转化成SrCO3的离子方程式为:_______________________________________,该反应的平衡常数表达式为_____________________________________;该反应能发生的原因是:________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
①升高温度,平衡常数K将__________________________________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrSO4。实验所用的试剂为________;实验现象及其相应结论为______________________。
【答案】![]()
![]()
![]()
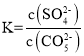
![]() ,加
,加![]() 后,平衡
后,平衡![]()
![]()
![]() 正向移动,生成SrCO3 减小 不变 盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化
正向移动,生成SrCO3 减小 不变 盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化
【解析】
(1)SrSO4转化成SrCO3的原因是依据物质溶解度的不同实现,反应向更难溶的方向进行;依据沉淀转化的反应方程式结合平衡常数概念写出表达式即可,依据溶解平衡的有关理论解释即可;
(2)①、平衡常数随温度变化,反应是放热反应,升温平衡逆向进行;
②、平衡常数不随浓度变化;
(3)、依据SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,说明SrCO3溶于酸,SrSO4不溶于酸,据此设计实验验证物质成分。
(1)、依据物质Ksp大小可知,SrSO4转化成SrCO3的溶解性不同,反应向更难溶的方向进行,依据沉淀转化写出离子方程式为:![]()
![]()
![]() ;该反应为的溶解平衡常数为:
;该反应为的溶解平衡常数为: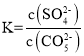 ;该反应能发生的原因是Ksp(SrCO3)< Ksp(SrSO4),加入CO32-后,平衡
;该反应能发生的原因是Ksp(SrCO3)< Ksp(SrSO4),加入CO32-后,平衡![]()
![]()
![]() 正向移动,生成SrCO3,故答案为:
正向移动,生成SrCO3,故答案为:![]()
![]()
![]() ;
;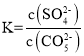 ;
;![]() ,加
,加![]() 后,平衡
后,平衡![]()
![]()
![]() 正向移动,生成SrCO3;
正向移动,生成SrCO3;
(2)①、实验证明降低温度都有利于提高SrSO4的转化率,说明平衡正向进行,正反应为放热反应,所以升高温度平衡逆向进行,平衡常数K减小,故答案为:减小;
②、增大CO32-的浓度平衡正向进行,平衡常数随温度变化,不随浓度改变,所以平衡常数不变,故答案为:不变;
(3)、SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,说明SrCO3溶于酸,SrSO4不溶于酸,证明上述过程中SrSO4是否完全转化成SrCO3,实验所用试剂为盐酸;若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则为不完全转化,故答案为:盐酸;若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则为不完全转化。

【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。
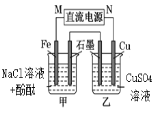
【题目】下列说法正确的是
A | B | C | D |
通电一段时间后,搅拌均匀,溶液的pH增大 | 此装置可实现 铜的精炼 | 盐桥中的K+ 移向FeCl3溶液 | 若观察到甲烧杯中石墨电极附近先变红,则乙烧杯中铜电极为阳极 |
|
|
|
|
A. A B. B C. C D. D
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。