题目内容
【题目】物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

回答下列问题:
(1)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为__________________________。
②D与乙反应的离子方程式为_________________________________________
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________生产设备名称为:__________
②D和乙反应的离子方程式为______________________________________________
③ 请简述检验D溶液中阳离子的方法__________________________________。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________(列出计算式即可)。
【答案】3NO2+H2O=NO+2HNO3 2Al+2OH-+2H2O = 2AlO2-+3H2↑ 4FeS2+11O2![]() 2Fe2O3+8SO2 沸腾炉 2Fe3+ + Fe =3Fe2+ 取少量D溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子
2Fe2O3+8SO2 沸腾炉 2Fe3+ + Fe =3Fe2+ 取少量D溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子 ![]()
【解析】
(1)用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知A为NH3,则C为NO,E为NO2,G为HNO3,B为H2O;甲为焰色反应呈黄色的金属单质,应为Na;D和F的溶液均呈碱性,可推知D为NaOH,乙为金属单质,常温下,它在浓硝酸中发生钝化,且与NaOH溶液反应生成F,则乙为Al、F为NaAlO2;
(2)C为无色气体,是形成酸雨的大气污染物之一,则C为SO2,结合转化关系可推知,E为SO3,G为H2SO4.A与氧气反应生成B与二氧化硫,B为红棕色的固体,A的相对分子质量为120,可推知A为FeS2、B为Fe2O3;甲由两种单质直接化合得到,与氧化铁反应生成D,D的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2。
(1)用两根玻璃棒分别蘸取X和D的浓溶液并使二者靠近时,有大量白烟生成,应为NH3和挥发性酸的反应,由转化关系可知A为NH3,则C为NO,E为NO2,G为HNO3,B为H2O;甲为焰色反应呈黄色的金属单质,应为Na;D和F的溶液均呈碱性,可推知D为NaOH,乙为金属单质,常温下,它在浓硝酸中发生钝化,且与NaOH溶液反应生成F,则乙为Al、F为NaAlO2,则:
①反应Ⅲ的化学方程式为:3NO2+H2O=2HNO3+NO;
②D与乙反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)C为无色气体,是形成酸雨的大气污染物之一,则C为SO2,结合转化关系可推知,E为SO3,G为H2SO4;A与氧气反应生成B与二氧化硫,B为红棕色的固体,A的相对分子质量为120,可推知A为FeS2、B为Fe2O3;甲由两种单质直接化合得到,与氧化铁反应生成D,D的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成,含有Cl-,可推知甲为HCl,D为FeCl3,乙为长周期金属单质,常温下,它在浓硫酸中发生钝化,应为Fe,与氯化铁溶液反应生成F,F的溶液中只含有一种溶质,则F为FeCl2,则:
①工业上,反应I的化学方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2,发生该反应的装置为沸腾炉;
2Fe2O3+8SO2,发生该反应的装置为沸腾炉;
②D和乙反应的离子方程式为:2Fe3++Fe=3Fe2+;
③检验FeCl3溶液中阳离子的方法是:取少许D溶液于试管中,滴加1~2滴硫氰化钾溶液,溶液呈红色,说明含有Fe3+离子;
④令该样品中FeS2的质量分数为y,则:
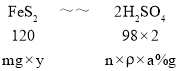
则有,![]() =
=![]() ,解得y=
,解得y=![]() ×100%。
×100%。

 名校课堂系列答案
名校课堂系列答案【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g) 2Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小