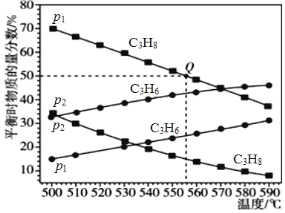
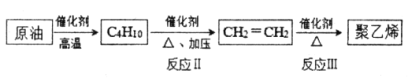
题目内容
【题目】如图为元素周期表的一部分,请参照①-⑨在表中的位置,回答下列问题:(用元素符号或化学用语回答)

(1)由①②⑧三种元素形成的常见化合物的电子式为_____,其包含的化学键类型为_____(填“离子键”、“共价键”)。
(2)⑦和⑨能以原子个数1:2形成化合物,用电子式表示其形成过程______________。
(3)金属性最强是____________。
(4)③的简单氢化物的沸点比⑦的简单氢化物的沸点___(填“高”或“低”),理由_____________。
(5)元素⑥的单质和④的最高价氧化物的水化物之间发生反应的离子方程式为:____________。
(6)在②的化合物中,红棕色、有刺激性气味的有毒气体是___________(填写化学式),请写出该气体与水反应的化学方程式________________________。
(7)⑦的最高价氧化物对应水化物的浓溶液在加热时与碳发生反应的化学方程式为:_________
【答案】)![]() 离子键 共价键
离子键 共价键 ![]() K 高 水分子间形成氢键 2Al+2OH-+2H2O=2AlO2-+3H2↑ NO2 3NO2+H2O=2HNO3 +NO C+2H2SO4(浓)
K 高 水分子间形成氢键 2Al+2OH-+2H2O=2AlO2-+3H2↑ NO2 3NO2+H2O=2HNO3 +NO C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
根据元素在周期表的位置,可确定从①到⑨号元素分别是H、N、O、Na、Mg、Al、S、Cl、K,然后利用元素的位、构、性的关系和元素周期律分析解答。
(1)由①②⑧三种元素形成的常见化合物是NH4Cl,该物质为离子化合物,NH4+与Cl-通过离子键结合,NH4+中N原子与H原子通过共价键结合,因此NH4Cl的电子式为![]() ,其中包含的化学键类型为离子键、共价键。
,其中包含的化学键类型为离子键、共价键。
(2)⑦和⑨能以原子个数1:2形成化合物是K2S,该物质是离子化合物,K+与S2-之间通过离子键结合,用电子式表示其形成过程为![]() 。
。
(3)由于同一周期的元素原子序数越大,元素的金属性越弱,同一主族的元素,原子序数越大,元素的金属性越强,所以上述元素中金属性最强是K。
(4)③的简单氢化物H2O的沸点比⑦的简单氢化物H2S的沸点高,这是由于水分子间形成氢键,增加了分子之间的吸引力,使物质气化需要消耗更多的能量。
(5)元素⑥Al的单质和④的最高价氧化物的水化物NaOH在水溶液中发生反应,产生偏铝酸钠和氢气,发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。
(6)②是N元素,在②的化合物中,红棕色、有刺激性气味的有毒气体是NO2,该气体与水反应产生硝酸和NO,该反应的化学方程式为3NO2+H2O=2HNO3 +NO。
(7)⑦是S,S元素的最高价氧化物对应水化物的浓溶液浓硫酸具有强的非氧化性,在加热时与碳发生反应,产生CO2、SO2、H2O,反应的化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案