题目内容
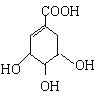
【题目】已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )

A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
【答案】C
【解析】
由于加入过量的氯水和四氯化碳后,下层呈紫红色,所以原溶液中含有碘离子,上层溶液加氢氧化钠溶液产生红褐色沉淀,说明加入氯水后溶液中存在铁离子,又因铁离子氧化性大于碘单质,因此原溶液中存在亚铁离子而不存在铁离子,根据离子共存可知原溶液不存在碳酸根离子,产生气体说明原溶液中含有铵离子,所得溶液进行焰色反应实验透过蓝色钴玻璃观察到紫色火焰,因此原溶液中含有钾离子,又因溶液中各离子浓度相同,根据电荷守恒分析可知原溶液中存在硫酸根离子和氯离子,故原溶液中一定含有硫酸根、碘离子、亚铁离子和钾离子、铵离子和氯离子。
A.根据上述分析可知原溶液中不存在铁离子,A项错误;
B.根据上述分析可知原溶液中不存在钠离子,B项错误;
C.根据上述分析可知该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的,C项正确;
D.由于原溶液中存在有硫酸根,加入氯化钡后只产生硫酸钡沉淀,不溶于盐酸,D项错误。
故答案选C。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
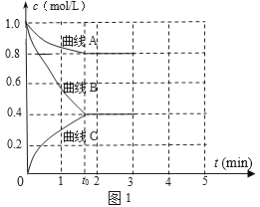
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
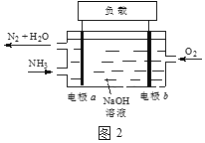
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。