题目内容
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固体(溶液体积变化、温度变化忽略不计),测得溶液中离子浓度的关系如图所示,下列说法正确的是( )

已知:Ksp(BaCO3)=2.40![]() 10-9
10-9
A.A、B、C三点对应溶液pH的大小顺序为:A>B>C
B.A点对应的溶液中存在:c(CO32-)< c(HCO3-)
C.B点溶液中 c(CO32-)=0.24mol/L
D.向C点溶液中通入CO2可使C点溶液向B点溶液转化
【答案】A
【解析】
A.CO32-的水解能力强于HCO3-,因此溶液中的CO32-的浓度越大,溶液中的OH-的浓度越大,pH越大。溶液中的CO32-的浓度越大,则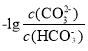 的值越小,从图像可知,A、B、C三点对应的溶液的
的值越小,从图像可知,A、B、C三点对应的溶液的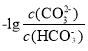 的值依次增大,则溶液的pH依次减小,pH的排序为A>B>C,A正确;
的值依次增大,则溶液的pH依次减小,pH的排序为A>B>C,A正确;
B.A点对应的溶液的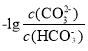 小于0,可知
小于0,可知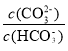 >0,可知c(CO32-)>c(HCO3-),B错误;
>0,可知c(CO32-)>c(HCO3-),B错误;
C.B点对应的溶液的lgc(Ba2+)=-7,则c(Ba2+)=10-7mol·L-1,根据Ksp(BaCO3)=c(Ba2+)c(CO32-)= 2.40![]() 10-9,可得c(CO32-)=
10-9,可得c(CO32-)= ![]() ,C错误;
,C错误;
D.通入CO2,CO2与水反应生成H2CO3,H2CO3第一步电离产生较多的HCO3-,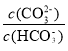 减小,则
减小,则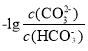 增大,C点不能移动到B点,D错误。
增大,C点不能移动到B点,D错误。
答案选A。

练习册系列答案
相关题目