题目内容
9.离子方程式mFe2++4H++O2=mFe3++2H2O,则m为( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 离子反应中,电荷守恒,以此来解答.
解答 解:离子反应中,电荷守恒,则m×2+4×(+1)=m×3,解得m=4,故选D.
点评 本题考查离子反应方程式,为高频考点,把握电荷守恒为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.在无色透明酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、NO3-、SO42-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
20.现有NH4Cl、K2SO4、(NH4)2SO4 三种化肥,只用下列一种试剂可将它们区别开来的是( )
| A. | CuSO4溶液 | B. | 盐酸 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
17.只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物,如NaH.NaH是一种重要的生氢剂.它与水反应的方程式为:NaH+H2O═NaOH+H2↑.下面说法正确的是( )
| A. | NaH中H的化合价为-1价 | B. | H2O既不是氧化剂也不是还原剂 | ||
| C. | 该反应的离子方程式为:H-+H+═H2↑ | D. | NaOH是氧化产物 |
4.铜锌原电池(如图)工作时,下列叙述正确的是( )
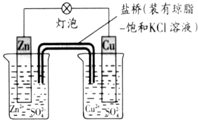

| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
1.海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:
(1)海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,该海水中Ca2+的物质的量浓度为5×10-3 mol/L.
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如如图1所示.其中阴(阳)离子交换膜只允许
阴(阳)离子通过.
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工
作原理如图2所示:
该电池的电解质是能传导 Li+的固体材料.
则放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(4)利用海洋资源可获得MnO2.MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾.该制备过程中消耗相同条件下空气和氯气的体积比为5:1(空气中氧气的体积分数按20%计).

| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如如图1所示.其中阴(阳)离子交换膜只允许
阴(阳)离子通过.
①阴极的电极反应式为2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力.锂是制造化学电源的重要原料,如LiFePO4电池某电极的工
作原理如图2所示:
该电池的电解质是能传导 Li+的固体材料.
则放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(4)利用海洋资源可获得MnO2.MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾.该制备过程中消耗相同条件下空气和氯气的体积比为5:1(空气中氧气的体积分数按20%计).

18.下列说法正确的是( )
| A. | 化学反应不一定伴随着能量的变化 | |
| B. | 氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=571.6kJ•mol-1 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |