题目内容
1.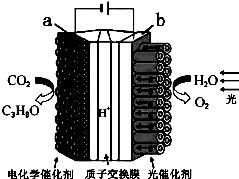 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O |
分析 根据图知,电解时a是阴极、b是阳极,a电极上CO2得电子生成C3H8O,阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-=O2↑+4H+,
A.该装置有外接电源,属于电解池;
B.电解时,电解质溶液中阴离子向阳极移动、阳离子向阴极移动;
C.根据转移电子守恒计算被还原CO2质量;
D.阳极上CO2得电子生成C3H8O.
解答 解:根据图知,电解时a是阴极、b是阳极,a电极上CO2得电子生成C3H8O,阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-=O2↑+4H+,
A.该装置有外接电源,属于电解池,是将电能转化为化学能的装置,故A错误;
B.电解时,电解质溶液中阴离子向阳极移动、阳离子向阴极移动,所以该装置工作时,H+从b极区向a极区迁移,故B错误;
C.每生成1molO2,转移电子4mol,被还原m(CO2)=$\frac{4mol}{4-(-2)}×44g/mol$=29.3g,故C错误;
D.阳极上CO2得电子生成C3H8O,电极反应式为3CO2+18H++18e-=C3H8O+5H2O,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,易错选项是C,注意C3H8O中C元素化合价的计算方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.反应A(g)+3B(g)═2C(g)+2D(g)在不同情况下测得反应速率,其中反应最快的是( )
| A. | v(A)=0.5mol(L•min) | B. | v(B)=0.9mol(L•min) | C. | v(C)=1.2mol(L•min) | D. | v(D)=0.4mol(L•min) |
12.氯化镁溶液的密度为1.20g/cm3,其中镁离子的质量分数为a%,该溶液中c(Cl-)为( )
| A. | 0.5a mol/L | B. | a mol/L | C. | 2.5a mol/L | D. | 5a mol/L |
9.由 转变成
转变成 需经过下列合成途径的顺序是( )
需经过下列合成途径的顺序是( )
 转变成
转变成 需经过下列合成途径的顺序是( )
需经过下列合成途径的顺序是( )| A. | 消去→加成→消去 | B. | 加成→消去→脱水 | C. | 加成→消去→加成 | D. | 取代→消去→加成 |
6.某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如表:
(1)制取新制Cu(OH)2悬浊液的离子方程式为Cu2++2OH-═Cu(OH)2↓.
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O=Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:
填写如表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:2Cu(OH)2+2Cl-+SO2═2CuCl↓+SO42-+2H2O.
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入  | 实验Ⅰ | 1.5mL 1mol?L-1 CuSO4溶液和3.5mL 1mol?L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5mL 1mol?L-1 CuCl2溶液和3.5mL 1mol?L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O=Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:

填写如表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
13.在无色透明酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、NO3-、SO42-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
17.只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物,如NaH.NaH是一种重要的生氢剂.它与水反应的方程式为:NaH+H2O═NaOH+H2↑.下面说法正确的是( )
| A. | NaH中H的化合价为-1价 | B. | H2O既不是氧化剂也不是还原剂 | ||
| C. | 该反应的离子方程式为:H-+H+═H2↑ | D. | NaOH是氧化产物 |