题目内容
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 |
| C.物质自身的性质 | D.催化剂的加入 |
C
解析试题分析:影响化学反应速率的因素有内因和外因。内因是参加化学反应的物质本身的性质,它起决定性的作用,是根本因素,而温度和压强、反应物的浓度、催化剂、光、颗粒的大小等只是在内因不变的情况下所其的作用,是辅助型的因素,是外因。因此选项为C。
考点:考查影响化学反应速率的因素的知识。

练习册系列答案
相关题目
(6分)按要求回答下列问题
(1)把锌片投入到盛有盐酸的敞口容器中,产生H2的速率可由图⑴表示。
在下列因素中对产生H2速率有影响的是 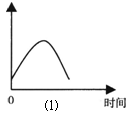
①盐酸的浓度 ②锌片的表面积 ③溶液的温度 ④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
2SO2+O2 2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
| A.减少O2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.一定条件下达到反应限度时SO2部分转化为SO3 |
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大 |
| D.升高温度,平衡常数一定增大 |
在673K、30MPa下,在密闭容器中进行合成氨反应: N2(g)+3H2(g) 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
| A.正反应速率:a点小于b点 |
| B.c点处反应达到平衡 |
| C.d点和e点处的n(N2)不一样 |
| D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是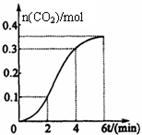
| A.反应开始2分钟内平均反应速率最大 |
| B.反应4分钟后平均反应速率最小 |
| C.反应开始4分钟内温度对反应速率的影响比浓度大 |
| D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
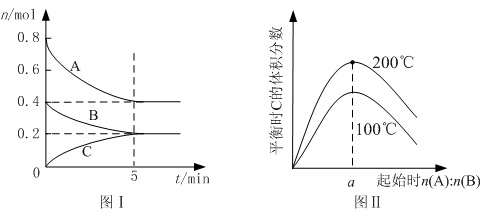
 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是 ( )