题目内容
10. 可逆反应X2(g)+3Y2(g)═2Z2(g)在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
可逆反应X2(g)+3Y2(g)═2Z2(g)在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t2-t3,各物质的浓度不再发生变化 | |
| B. | t3时刻改变温度,该反应限度不会改变 | |
| C. | t2-t3,反应不再发生 | |
| D. | t1时,反应只向正方向进行 |
分析 A.t2-t3,正逆反应速率相等,该反应达到平衡状态;
B.t3时刻改变温度,平衡被破坏,直至达到新的平衡状态;
C.t2-t3,正逆反应速率相等,该反应达到平衡状态;
D.t1时,正逆反应同时进行,只是正反应速率大于逆反应速率,平衡向正反应方向移动.
解答 解:A.t2-t3,正逆反应速率相等,该反应达到平衡状态,所以各物质浓度不再发生变化,故A正确;
B.t3时刻改变温度,平衡被破坏,平衡向着减弱这种改变的方向移动,直至达到新的平衡状态,所以反应限度改变,故B错误;
C.t2-t3,该反应达到平衡状态,正逆反应速率相等但不是0,为动态平衡状态,故C错误;
D.t1时,正逆反应同时进行,只是正反应速率大于逆反应速率,平衡向正反应方向移动,故D错误;
故选A.
点评 本题考查图象分析,明确图中纵横坐标含义是解本题关键,会根据反应速率相对大小确定反应方向,注意:反应限度是有条件的,条件改变限度被破坏.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.“化学无处不在”,下列与化学有关的说法不正确的是( )
| A. | 由于甲酸的缘故,人被蜂蚁蜇咬后会感觉疼痛难忍,涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| B. | 用浸过酸性高锰酸钾溶液的硅藻土吸收水果、花朵产生的乙烯,可以延长果实或花朵的成熟期 | |
| C. | 将金属与电源正极相连可有效保护金属不被腐蚀 | |
| D. | 泡沫灭火器利用双水解原理喷出泡沫覆盖在燃烧物品上,使燃着的物质与空气隔离,并降低温度,达到灭火的目的 |
1.近期我国中东部地区连续多日出现阴霾均系环境污染造成的,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
| A. | 温室效应--CO2 | B. | 光化学污染--NO2 | C. | 酸雨--SO2 | D. | 臭氧层破坏--CO |
18.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | 原子半径:D>E>C>B>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
5.下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第三周期元素的是ACEG(用表中元素编号填写).写出H的最高价氧化物的结构式:O=C=O.
(2)比较A、D、G三种简单阴离子的半径大小:r(S2-)>r(Cl-)>r(O2-).比较元素F、G的氢化物的沸点高低,并说明理由F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高.(均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(5)以下说法正确的是bc(填编号).
a.元素H与元素C的单质、其氢化物、最高价氧化物的沸点都是H的高
b.工业上单质C的制备要用到单质H、G;单质C可以与强碱、F的氢化物的水溶液反应
c.能说明元素D的非金属性比A强的实验:把D的单质通入到A的氢化物的水溶液来实现.
15.电化学在日常生活中有广泛的应用,下列说法或做法正确的是( )
| A. | 暴雨后遭洪水浸泡的铁门生锈是因为发生化学腐蚀 | |
| B. | 白铁皮(铁镀锌)表面有划损时,不能阻止铁被腐蚀 | |
| C. | 废弃的干电池不能随意丢弃,但可以土埋处理 | |
| D. | 不能将铁制自来水管与铜制水龙头连接 |
2.已知2A(g)+B(g)?2C(g)△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量为b kJ.
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度=(填“>”、“=”或“<”)w mol/L,a、b、c之间满足何种关系a=b+c(用代数式表示).
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”“=”或“<”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是D.
A.4mol A和2mol B B.4mol A、2mol B和2mol C
C.4mol A和4mol B D.6mol A和4mol B
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C气体 B.适当升高温度C.增大B的浓度 D.选择高效催化剂
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则d>b(填“>”“=”或“<”).
(5)在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量不变(填“不变”“变大”“变小”或“无法确定”).
19.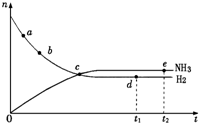 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d (t1时刻)和点e (t2时刻)处n (N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
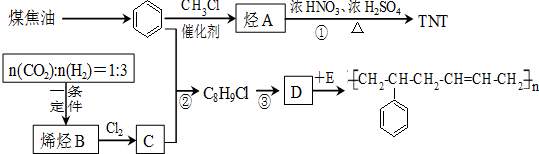
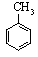 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$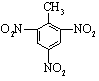 +3H2O.
+3H2O.