题目内容
【题目】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ. CO还原法
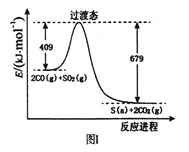
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______(填“放出”或“吸收”)的热量为_________。
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
S(s)+2CO2(g),该反应的平衡常数表达式为_______。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
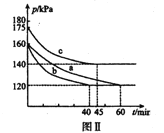
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)![]() S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______b ______c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________。
Ⅱ.Na2SO3溶液吸收法
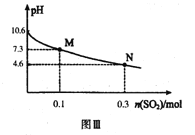
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A. NH3·H2O B. Na2S C. Na2CO3 D. FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________。
【答案】 放出 135KJ K=c2(CO2)/[c2(CO2)·c(SO2)] A、D = < 6.25×10-3mol/(L·min) c(Na+)>c(SO32-)>c(OH-)>c(HSO4-)>c(H+) B 10-7.3
【解析】Ⅰ. CO还原法
(1)从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,2CO(g)+SO2(g) ![]() S(s)+2CO2(g),反应热为△H=(409-679)kJ/mol=―270kJ/mol,故生成16gS放出的热量为16g/32g·mol-1×270kJ/mol=135kJ;(2)2CO(g)+SO2(g)
S(s)+2CO2(g),反应热为△H=(409-679)kJ/mol=―270kJ/mol,故生成16gS放出的热量为16g/32g·mol-1×270kJ/mol=135kJ;(2)2CO(g)+SO2(g) ![]() S(s)+2CO2(g),该反应的平衡常数表达式为 K=c2(CO2)/[c2(CO2)·c(SO2)],注意硫为固体;对此反应下列说法正确的是AD。A.若混合气体密度保持不变,因为S是固体,只要平衡发生移动,组成就要发生变化,则已达平衡状态,故A正确;B.2CO(g)+SO2(g)
S(s)+2CO2(g),该反应的平衡常数表达式为 K=c2(CO2)/[c2(CO2)·c(SO2)],注意硫为固体;对此反应下列说法正确的是AD。A.若混合气体密度保持不变,因为S是固体,只要平衡发生移动,组成就要发生变化,则已达平衡状态,故A正确;B.2CO(g)+SO2(g) ![]() S(s)+2CO2(g)是气体体积减小的反应,反应开始到平衡时,容器内气体的压强发生改变,故B错误;C.达平衡后若再充人一定量CO2,平衡逆向移动,要吸收能量,在绝热恒容的密闭容器中,温度要降低,平衡常数减小,,故C错误;D.分离出S,对生成物浓度没有影响,正、逆反应速率均保持不变,故D错误。故选AD。(3)a和b反应起始压强相同,平衡时压强相同,b快说明加的是催化剂,如温度不同,最后平衡时压强不同,故温度a=b;升高温度,平衡逆向移动,压强增大,故b的温度低于c,故三组实验温度的关系是a=b <c ;由图a反应前后压强之比=反应前后物质的量之比,
S(s)+2CO2(g)是气体体积减小的反应,反应开始到平衡时,容器内气体的压强发生改变,故B错误;C.达平衡后若再充人一定量CO2,平衡逆向移动,要吸收能量,在绝热恒容的密闭容器中,温度要降低,平衡常数减小,,故C错误;D.分离出S,对生成物浓度没有影响,正、逆反应速率均保持不变,故D错误。故选AD。(3)a和b反应起始压强相同,平衡时压强相同,b快说明加的是催化剂,如温度不同,最后平衡时压强不同,故温度a=b;升高温度,平衡逆向移动,压强增大,故b的温度低于c,故三组实验温度的关系是a=b <c ;由图a反应前后压强之比=反应前后物质的量之比, ![]() ,反应后物质的量为n=2.25mol,每有1molSO2参加反应,反应气体体积减少1体积,所以参加反应的SO2为3mol―2.25mol=0.75mol,v(SO2)=
,反应后物质的量为n=2.25mol,每有1molSO2参加反应,反应气体体积减少1体积,所以参加反应的SO2为3mol―2.25mol=0.75mol,v(SO2)=![]() 。
。
Ⅱ、(4)Na2SO3水溶液中,有Na+,SO32-,HSO3-,OH-,H+,首先,根据物料守恒c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)(溶液中Na元素是S元素的2倍),可知Na+浓度是最大的,SO32-的水SO32-+H2O![]() (可逆)HSO3-+OH-,水解是微弱的,所以SO32-的浓度大于HSO3-和OH-
(可逆)HSO3-+OH-,水解是微弱的,所以SO32-的浓度大于HSO3-和OH-
HSO3-进一步水HSO3-+H2O![]() (可逆)H2SO3+OH-,虽然这一步水解极其微弱,但毕竟是存在,这将导致OH-的浓度大于HSO3-(另外还有水的电解),1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为 c(Na+)>c(SO32-)>c(OH-)>c(HSO4-)>c(H+) 。(5)若用等体积、等物质的量浓度的下列溶液(设溶质为1mol)分别吸收SO2,A、2NH3·H2O+SO2=(NH4)2SO3+H2O,吸收 0.5mol;B、2Na2S+5SO2+2H2O=4NaHSO3+3S ,1molNa2S吸收2.5molSO2;C、Na2CO3+2SO2+H2O=2NaHSO3+CO2 1molNa2CO3吸收2molSO2;D、2Fe3++SO2+2H2O
(可逆)H2SO3+OH-,虽然这一步水解极其微弱,但毕竟是存在,这将导致OH-的浓度大于HSO3-(另外还有水的电解),1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为 c(Na+)>c(SO32-)>c(OH-)>c(HSO4-)>c(H+) 。(5)若用等体积、等物质的量浓度的下列溶液(设溶质为1mol)分别吸收SO2,A、2NH3·H2O+SO2=(NH4)2SO3+H2O,吸收 0.5mol;B、2Na2S+5SO2+2H2O=4NaHSO3+3S ,1molNa2S吸收2.5molSO2;C、Na2CO3+2SO2+H2O=2NaHSO3+CO2 1molNa2CO3吸收2molSO2;D、2Fe3++SO2+2H2O![]() 2Fe2++4H++SO42―,1molFeCl3吸收0.5molSO2;故选B;(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为
2Fe2++4H++SO42―,1molFeCl3吸收0.5molSO2;故选B;(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为
Na2SO3+H2O+SO2=2NaHSO3,当通入0.1molSO2时,生成0.2molNaHSO3,浓度为0.2mol/0.3L=2/3mol/L,此时剩余的c(SO32―)=0.2mol/0.3L=2/3mol/L,c(H+)=10-7.3mol/L,Ka2=c(H+)=10-7.3mol/L。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案