题目内容
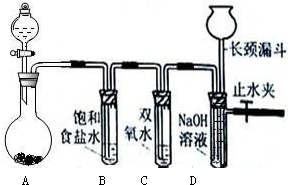
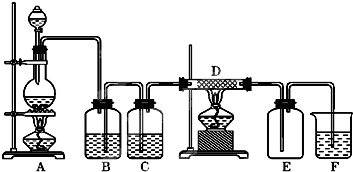
某化学学习小组在进行知识整理时发现如下规律:有些反应随着溶液由浓变稀,可能导致“量变引起质变”,实验室制取氯气就是这样.用下列两种方法制取氯气:①用含HCl146g的浓盐酸与足量的MnO2反应;②用87gMnO2与足量的浓盐酸反应.不考虑HCl的挥发,则两种方法生成的氯气的量是:方法①______(填“>”、“<”或“=”)方法②.
实验室制取氯气的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,MnO2不能氧化稀盐酸,
①用含HCl146g的浓盐酸与足量的MnO2反应;146g的浓盐酸的物质的量为:n(HCl)=
=0.4mol,根据MnO2与浓HCl反应,随着反应的进行,浓HCl变稀,稀盐酸不能与MnO2反应,MnO2足量时,不能准确计算出氯气的量,故反应①中产生的氯气小于0.1mol;
②87gMnO2的物质的量为:n(MnO2)=
=
=1mol,用87gMnO2与足量的浓盐酸反应,不考虑HCl的挥发,浓盐酸足量时,根据MnO2与浓HCl反应,计算出氯气的量为0.1mol;
所以两种方法生成的氯气的量是:方法①<方法②,
故答案为:<;
| ||
①用含HCl146g的浓盐酸与足量的MnO2反应;146g的浓盐酸的物质的量为:n(HCl)=
| 146g |
| 36.5g/mol |
②87gMnO2的物质的量为:n(MnO2)=
| m |
| M |
| 87g |
| 87g/mol |
所以两种方法生成的氯气的量是:方法①<方法②,
故答案为:<;

练习册系列答案
相关题目