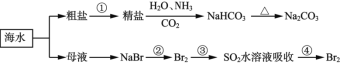
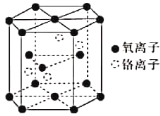
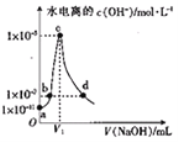
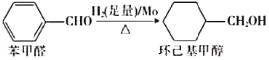题目内容
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①Fe2+的电子排布式为[Ar]________________________________。
②与SO42-互为等电子体的分子有____________________(写一种)。
③ClO2-中氯原子的孤电子对数为___________。
④常用K3[Fe(CN)6]检验水中的F2+。K3[Fe(CN)6]的配体是________________。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2________________(填“>”“<”或“=”)Cl2O,理由是________________________________________________。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(2)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:![]()
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了________。
,这样的书写不正确,违背了________。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是_______。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为_______________________。
(3)NO能被FeSO4溶液吸收生成配合物![]() ,该配合物中心离子的配位数为__________________________。
,该配合物中心离子的配位数为__________________________。
(4)研究发现,阳离子的颜色与未成对电子数有关。例如,Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_____________________________。
【答案】3d6 CCl4或SiF4 2 CN- < 后者相对分子质量较大,范德华力较大 洪特规则 乙醇分子间存在范德华力和氢键,乙醛分子间只存在范德华力 sp2 6 Cu+无未成对电子
【解析】
I.(1)①Fe2+为Fe失去最外层的2个电子形成的离子;
②与SO42-互为等电子体的分子,即含有5个原子,32个电子的分子;
③根据孤电子对数=![]() (a-bx)计算;
(a-bx)计算;
(2)分子晶体的分子量越大,分子间的作用力越大,熔沸点就越高。
I.(1)①铁为第26号元素,排布式为[Ar]3d64s2,Fe2+为Fe失去最外层的2个电子形成的离子,其排布式为[Ar]3d6;
②与SO42-互为等电子体的分子,即含有5个原子,32个电子的分子有四氯化碳、四氟化硅等;
③孤电子对数=![]() (a-bx)=
(a-bx)=![]() (7+1-2×2)=2;
(7+1-2×2)=2;
④[Fe(CN)6]3-为中心配离子,而CN-为配体;
(2)ClO2、Cl2O均为分子晶体,分子晶体的分子量越大,分子间的作用力越大,熔沸点就越高,则沸点:ClO2<Cl2O;
Ⅱ.(1)①根据洪特规则可知,在相同能级的电子,电子的自旋方向相同;
②乙醇分子间存在范德华力和氢键,氢键的作用力大于乙醛分子间的作用力,导致沸点升高;
(2)NO3-中心N原子的孤电子对数=![]() (a-bx)=
(a-bx)=![]() (5+1-2×3)=0,N原子与O原子间存在3条共价键,无孤电子对,则为sp2杂化;
(5+1-2×3)=0,N原子与O原子间存在3条共价键,无孤电子对,则为sp2杂化;
(3)根据化合物[Fe(NO)(H2O)5]SO4,配体为NO、H2O,个数分别为1、5,则配位数为6;
(4)Cu的价电子排布式为3d104s1,则Cu+排布式为[Ar]3d10,无未成对电子。

【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
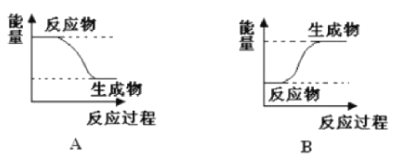
I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_____(填写化学式)。