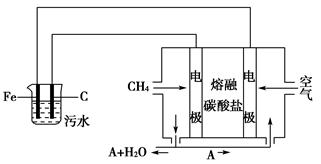
题目内容
一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池, 2CH3OH + 3O2 + 4OH-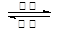 2CO32- + 6H2O,则下列说法正确的是
2CO32- + 6H2O,则下列说法正确的是
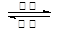 2CO32- + 6H2O,则下列说法正确的是
2CO32- + 6H2O,则下列说法正确的是| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时溶液中的OH- 移向正极 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32- + 6H2O |
D
试题分析:A.燃料电池的电极可以是石墨,所以构成该电池的正极和负极可能是石墨,故A错误;B.充电时,碳酸根离子得电子生成甲醇,则有CH3OH生成的电极为阴极,故B错误;C.放电时溶液中的OH- 移向负极,故C错误.D.放电时,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故D正确;故选D.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目

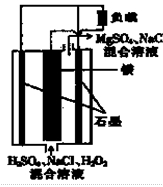
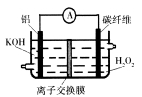
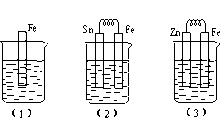
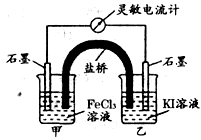
 2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是
2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是