题目内容
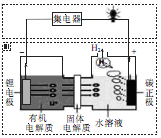
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是 ( )。
| A.电池工作时,MnO2失去电子 |
| B.电池工作时,电子由锌经外电路流向MnO2 |
| C.从反应方程式来看,不使用氢氧化钾,也不影响电流大小 |
| D.电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |
D
A项,二氧化锰中锰元素化合价从+4变为+3,故MnO2得电子,不正确;B项,碱性电池中二氧化锰不是电极材料,故电子由锌经外电路流向正极材料,不是二氧化锰;C项,氢氧化钾溶液是电解质溶液,既可以参与导电,也可以防止锌生成氧化物而影响电流大小,故不正确。

练习册系列答案
相关题目
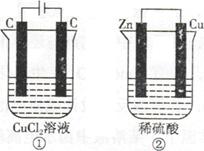
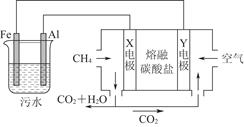
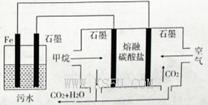


 2CO32- + 6H2O,则下列说法正确的是
2CO32- + 6H2O,则下列说法正确的是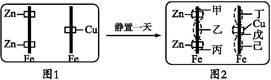
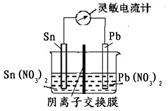
 Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )
Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )