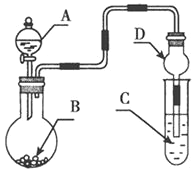
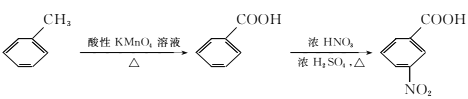
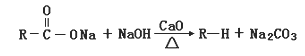题目内容
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题: 
(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 .
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是;
A.Mg2+
B.Fe2+
C.Al3+
D.Cu2+
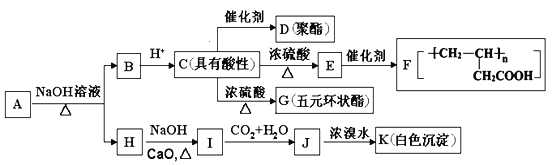
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如图:回答下列问题: ①操作Ⅰ的名称是 , 操作Ⅱ的名称是 .
②写出在空气中煅烧FeCO3的化学方程式;
(4)有些同学认为KMnO4溶液可以测定亚铁离子含量(5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O). a.称取2.850g绿矾(FeSO47H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL所配溶液于锥形瓶中;
c.加入20.00mL硫酸酸化的0.01mol/LKMnO4溶液恰好完全反应.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 . 定容时俯视刻度线,则c(KMnO4)(填偏大、偏小或不变)
②计算上述样品中FeSO47H2O的质量分数为 .
【答案】
(1)Fe2+、Fe3+、H+
(2)BC
(3)过滤;洗涤;4FeCO3+O2 ![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(4)250 mL容量瓶;偏大;0.975
【解析】解:(1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4 , 溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,溶液中大量存在的阳离子是Fe2+、Fe3+、H+ , 所以答案是:Fe2+、Fe3+、H+;(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化镁、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+ , 与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+ , 所以答案是:BC;(3)①由工艺流程可知,操作I是将固体与液体分离,应采取过滤的方法;FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质,所以答案是:过滤;洗涤;②在空气中煅烧FeCO3的化学方程式为4FeCO3+O2 ![]() 2Fe2O3+4CO2 , 所以答案是:4FeCO3+O2
2Fe2O3+4CO2 , 所以答案是:4FeCO3+O2 ![]() 2Fe2O3+4CO2;(4)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶,定容时俯视刻度线,体积偏小,由c=
2Fe2O3+4CO2;(4)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶,定容时俯视刻度线,体积偏小,由c= ![]() 可知,c偏大,所以答案是:250mL容量瓶;偏大;②n(MnO4﹣)=0.01000mol/L×0.02L=2×10﹣4mol,则由5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知n(Fe2+)=5×2×10﹣4mol=1×10﹣3mol, 所以250mL溶液中含有知n(Fe2+)=1×10﹣2mol,则m(FeSO47H2O)=278g/mol×1×10﹣2mol=2.780g,样品中FeSO47H2O的质量分数为
可知,c偏大,所以答案是:250mL容量瓶;偏大;②n(MnO4﹣)=0.01000mol/L×0.02L=2×10﹣4mol,则由5Fe2++MnO4﹣+8H+═5Fe3++Mn2++4H2O可知n(Fe2+)=5×2×10﹣4mol=1×10﹣3mol, 所以250mL溶液中含有知n(Fe2+)=1×10﹣2mol,则m(FeSO47H2O)=278g/mol×1×10﹣2mol=2.780g,样品中FeSO47H2O的质量分数为 ![]() =0.975,所以答案是:0.975.
=0.975,所以答案是:0.975.

【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH 液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:________________。
(2)下图是某笔记本电脑用甲醇燃料电池的结构示意图。
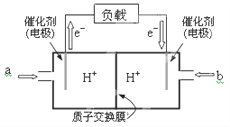
放电时甲醇应从______处通入(填“a”或“b”),电池内部H+向_____(填“左”或“右”)移动。写出电池负极的电极反应式:_______________________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H =________。