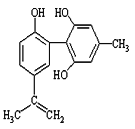
题目内容
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
【答案】D
【解析】
A. NA个O2和28g N2的物质的量都是1mol,若氧气和氮气所处的状态是标准状况,则1molO2和1molN2所占有的体积都约是22.4L,选项没有说明是在标况下,所以1molO2和1molN2所占有的体积可能为22.4L,可能不是,故A错误;
B. 标准状况下水是液体,不能使用气体摩尔体积22.4L/mol计算,故B错误;
C. 依据n=![]() 计算物质的量=
计算物质的量=![]() =1mol,结合氯气既是氧化剂又是还原剂,元素化合价0价变化为-1价和+1价,转移的电子数为1NA,故C错误;
=1mol,结合氯气既是氧化剂又是还原剂,元素化合价0价变化为-1价和+1价,转移的电子数为1NA,故C错误;
D. 1.8g NH4+的物质的量为![]() =0.1mol,1个NH4+有10个电子,0.1mol NH4+离子中含有的电子数NA,故D正确;
=0.1mol,1个NH4+有10个电子,0.1mol NH4+离子中含有的电子数NA,故D正确;
正确答案是D。

 名校课堂系列答案
名校课堂系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
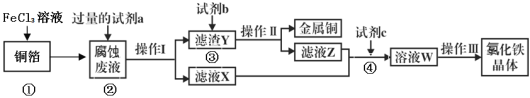
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
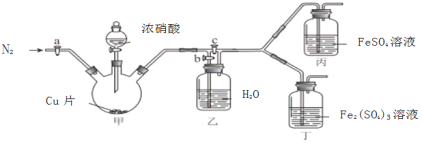
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。