题目内容
17.某有机物的结构简式为HO-CH2CH=CHCH2COOH,试写出下列方程式:与溴水的反应HO-CH2CH=CHCH2COOH+Br2→HOCH2CHBrCHBrCH2COOH
与乙酸的反应HOCH2CH=CHCH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH=CHCH2COOH+H2O
与乙醇的反应HOCH2CH=CHCH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$HOCH2CH=CHCH2COOCH2CH3+H2O.
分析 该物质中含有醇羟基、碳碳双键和羧基,能发生取代反应、酯化反应、加成反应、缩聚反应,能与溴发生加成反应,与乙酸发生酯化反应、与乙醇发生酯化反应,据此分析解答.
解答 解:与溴水发生加成反应,反应方程式为HO-CH2CH=CHCH2COOH+Br2→HOCH2CHBrCHBrCH2COOH;
与乙酸发生酯化反应,反应方程式为HOCH2CH=CHCH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH=CHCH2COOH+H2O;
与乙醇发生酯化反应,反应方程式为 HOCH2CH=CHCH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$HOCH2CH=CHCH2COOCH2CH3+H2O,
故答案为:HO-CH2CH=CHCH2COOH+Br2→HOCH2CHBrCHBrCH2COOH;
HOCH2CH=CHCH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH=CHCH2COOH+H2O;
HOCH2CH=CHCH2COOH+CH3CH2OH$?_{△}^{浓硫酸}$HOCH2CH=CHCH2COOCH2CH3+H2O.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、羧酸和烯烃性质,明确断键和成键方式即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.常温下下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | |
| C. | c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+ | |
| D. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
8.将30mL 5mol/L NaOH溶液加水稀释到60mL,稀释后溶液中NaOH的物质的量为( )
| A. | 0.25mol | B. | 2.5mol | C. | 0.15mol | D. | 1.5mol |
12.下列离子方程式正确的是( )
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
2.下列变化不需要破坏化学键的是( )
| A. | HCl气体溶于水 | B. | 碘晶体受热转变成碘蒸气 | ||
| C. | NaCl溶于水 | D. | 加热HI气体使之分解 |
9.某原电池的电池反应为:Fe+2Fe3+═3Fe2+,与此电池反应不符的原电池是( )
| A. | 铜片、铁片、FeCl3溶液组成的原电池 | |
| B. | 石墨、铁片、Fe(NO3)3溶液组成的原电池 | |
| C. | 银片、铁片、Fe(NO3)2溶液组成的原电池 | |
| D. | 铁片、铜片、Fe2(SO4)3溶液组成的原电池 |
7.下列各组物质中前一种是混合物,后两种是纯净物的是( )
| A. | 蓝矾 玻璃 无色的刚玉 | B. | 汽油 液氯 醋酸 | ||
| C. | 石蜡 纯盐酸 王水 | D. | 干冰 铝热剂 铁触媒 |
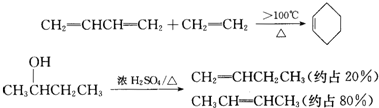

 ;C
;C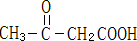 ;D
;D .
.