题目内容
7.下列各组物质中前一种是混合物,后两种是纯净物的是( )| A. | 蓝矾 玻璃 无色的刚玉 | B. | 汽油 液氯 醋酸 | ||
| C. | 石蜡 纯盐酸 王水 | D. | 干冰 铝热剂 铁触媒 |
分析 A、蓝帆是五水硫酸铜晶体,属于纯净物;
B、汽油含有多种烃,属于混合物;液氯 醋酸都是化合物;
C、纯盐酸含有HCl和H2O,王水含有HCl、HNO3、H2O;
D、干冰是固态CO2,属于纯净物.
解答 解:A、蓝帆是五水硫酸铜晶体,属于纯净物;玻璃含有多种成分,属于混合物,故A错误;
B、汽油含有多种烃,属于混合物;液氯 醋酸都是化合物,属于纯净物,故B正确;
C、纯盐酸含有HCl和H2O,王水含有HCl、HNO3、H2O,都属于混合物,故C错误;
D、干冰是固态CO2,属于纯净物;铝热剂 铁触媒含有多种成分,都是混合物,故D错误;
故选B.
点评 本题考查混合物与纯净物的区别,难度不大,注意混合物的多种成分.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(1)帮助该组同学完成以上实验设计表.
(2)该小组同学在对比①和⑤实验时发现①的反应速度都明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?Cl-能够促进Al与H+的反应或SO42-对Al与H+的反应起阻碍作用.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(1)帮助该组同学完成以上实验设计表.
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
12.下列关于有机物  的说法,不正确的是( )
的说法,不正确的是( )
 的说法,不正确的是( )
的说法,不正确的是( )| A. | 既可催化加氢,又能使酸性KMnO4溶液褪色 | |
| B. | 可与浓溴水发取代生反应,但不能发生消去反应 | |
| C. | 1mol该化合物最多可与10molNaOH反应 | |
| D. | 可与FeCl3溶液发生显色反应,不与NaHCO3反应放出CO2 |
19.为了测定某未知NaOH溶液的浓度,需要0.200mol•L-1的盐酸溶液500mL.某学生用实验室中常用的36.5%(密度为1.20g•cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验.
(1)请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序.
A.用b(从以下备选仪器中选取适当仪器将其序号填入)量(或称)取36.5%(密度为1.19g•cm-3)的浓盐酸8.3ml(填写所需体积或质量).
a.50mL量筒; b.10mL量筒; c.托盘天平.
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释.
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处.
D.等溶液恢复至室温.
E.将溶液用玻璃棒引流转入500ml容量瓶(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中.
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可.
以上各实验步骤的正确排列顺序是ABDECF.
(2)准确移取20.00mL待测NaOH溶液于一洁净锥形瓶中,然后用所配标准盐酸溶液进行滴定(以酚酞为指示剂).滴定结果如下表:
根据以上数据计算出未知NaOH溶液的物质的量浓度为0.22mol•L-1(精确到0.01).
(3)下列操作或叙述正确的是BC(填写序号).
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平.
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中.
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液.
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次.
(4)下列操作或现象会导致测定结果偏高的是ACE(填写序号).
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定.
(1)请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序.
A.用b(从以下备选仪器中选取适当仪器将其序号填入)量(或称)取36.5%(密度为1.19g•cm-3)的浓盐酸8.3ml(填写所需体积或质量).
a.50mL量筒; b.10mL量筒; c.托盘天平.
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释.
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处.
D.等溶液恢复至室温.
E.将溶液用玻璃棒引流转入500ml容量瓶(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中.
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可.
以上各实验步骤的正确排列顺序是ABDECF.
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
根据以上数据计算出未知NaOH溶液的物质的量浓度为0.22mol•L-1(精确到0.01).
(3)下列操作或叙述正确的是BC(填写序号).
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平.
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中.
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液.
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次.
(4)下列操作或现象会导致测定结果偏高的是ACE(填写序号).
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定.
9.将铜粉放入稀H2SO4中,加热无明显现象,但加入某化合物后,发现铜粉质量逐渐减少,则该化合物不可能是( )
| A. | Fe2(SO4)3 | B. | FeSO4 | C. | KNO3 | D. | Fe3O4 |
10.下列化合物中,既显酸性,又能发生加成反应、氧化反应、酯化反应和消去反应的是( )
| A. | 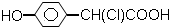 | B. | CH3CH (OH)-CH=CH-COOH | ||
| C. | CH3-CH=CH-COOH | D. | CH3CH(OH)CH2CHO |
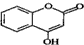 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: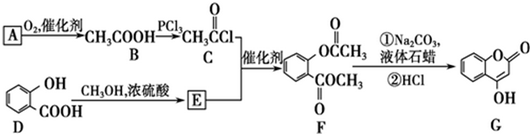
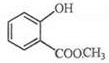 .
.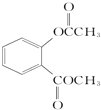 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.