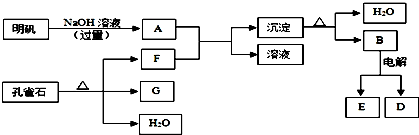
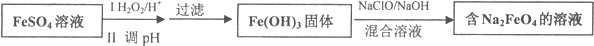题目内容
16.(1)将0.0lmol下列物质①Na2O2 ②Na2O ③Na2CO3 ④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是①=②>③>④(溶液体积变化忽略不计);(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
分析 (1)等物质的量的Na2O2与Na2O分别于水反应生成等物质的量的NaOH,消耗的水的量相同,生成的OH-浓度相同,均约为0.2mol/L,Na2CO3因水解,使阴离子浓度稍增大:CO32-+H2O?HCO3-+OH-;
(2)①先求得各物质平衡时的浓度,再根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,据此答题;
③根据浓度商Qc与平衡常数K的大小,判断反应进行的方向,进而确定正逆反应的速率;
(3)根据盖斯定律,将已知反应(①-②+③×4)÷2进行计算;
(4)NaHCO3不稳定,加热易分解,根据质量的变化利用差值法解答;
(5)结合反应的方程式2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑计算.
解答 解:(1)由①反应为2Na2O2+2H2O=4NaOH+O2↑,②反应为Na2O+H2O=2NaOH溶于水,二者消耗的水的量相同,生成等物质的量的NaOH,故生成的OH-浓度相同,均约为0.2mol/L,故为①=②;③中碳酸根水解使得阴离子浓度稍大于④,而④中NaCl的浓度为0.1mol/L,则所得溶液中阴离子浓度的大小顺序为:①=②>③>④,
故答案为:①=②>③>④;
(2)①实验1中平衡时CO的物质的量为2.4mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):4 2 0 0
变化(mol):1.6 1.6 1.6 1.6
平衡(mol):2.4 0.4 1.6 1.6
所以平衡常数K=$\frac{\frac{1.6}{2}×\frac{1.6}{2}}{\frac{2.4}{2}×\frac{0.4}{2}}$≈2.67,
故答案为:2.67;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则0<$\frac{a}{b}$<1,
故答案为:0<$\frac{a}{b}$<1;
③900℃时,H2O(g)+CO(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
初始 0.5mol/L 1mol/L 0 0
转化 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.2×0.2}{0.3×0.8}$=0.17;
若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,浓度商Qc=$\frac{\frac{2}{2}×\frac{5}{2}}{\frac{10}{2}×\frac{5}{2}}$=0.2>0.17=K,所以此时平衡要逆向移动,故V正<V逆,
故答案为:<;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-885.6KJ/mol,
则:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol,
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)NaHCO3不稳定,加热易分解,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
则2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑△m
168g 106g 62g
x bg
则:x=$\frac{168b}{62}$g,
则样品中Na2CO3的质量为:ag-$\frac{168b}{62}$g=$\frac{31a-84b}{31}$g,
所以该混合物样品中Na2CO3的质量分数是:$\frac{31a-84b}{31a}$,
故答案为:$\frac{31a-84b}{31a}$;
(5)设钠、钾的物质的量分别为a、b,反应的方程式为2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑,
则:a+b=0.075mol×2=0.15mol,
该溶液中氢氧根离子的物质的量浓度是:$\frac{0.15mol}{0.2L}$=0.75mol/L,
故答案为:0.75mol/L.
点评 本题考查离子浓度大小比较、化学平衡的计算、混合物反应的计算、盖斯定律在热化学方程式中的计算等知识,题目难度较大,试题知识点较多、计算量较大,充分考查学生的分析、理解能力及化学计算能力.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 29.5g | B. | 44g | C. | 74.8g | D. | 88g |
| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
| A. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| B. | 中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源 | |
| C. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| D. | 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体 |
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀;再加热,未见有气体放出;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;分液后,向水层加入BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
| A. | U元素的近似相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中中子数比质子数多51 | |
| C. | ${\;}_{92}^{235}$U与${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U属于同一种元素 |
 以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题: