题目内容
20.已知在比较酸的强弱时,必须考虑两方面:一是酸电离出氢离子的能力,二是溶剂接受氢离子的能力.比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc.下列关于酸性强弱的说法正确是( )| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
分析 A.在A溶剂中,甲的酸性大于乙,在B的溶剂中,甲的酸性肯定也大于乙;
B.根据酸、碱的定义进行判断;
C.HCl、H2SO4、HClO4、HNO3在水中完全电离,都为强酸,在醋酸中电离程度不同,可比较酸性强弱;
D.如果HCN和HAc在液氨中完全电离,则不能比较酸性强弱.
解答 解:A.如溶剂相同,电离出氢离子的能力越强,酸越强,在A溶剂中,甲的酸性大于乙,说明甲电离出氢离子的能力较强,则在B的溶剂中,甲的酸性肯定也大于乙,故A错误;
B.硝酸、硫酸都电离出氢离子,都为酸,不可能为碱,故B错误;
C.HCl、H2SO4、HClO4、HNO3在水中完全电离,都为强酸,在醋酸中电离程度不同,可比较酸性强弱,故C正确;
D.比较HCN与HAc酸性的强弱,用水肯定可以,如果HCN和HAc醋酸都在液氨中完全电离,则不能比较其酸性大小,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,题目难度中等,侧重于学生的分析能力和自学能力的考查,明确题给信息的含义为解答关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器在煤矿巷道中的甲烷达到一定浓度时可以显示示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述不正确的是,( )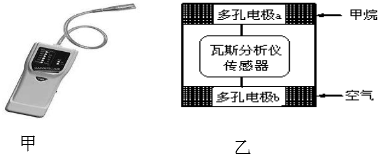

| A. | 电极b是正极,内电路中O2-由电极b流向电极a | |
| B. | 电极a的反应式为:CH4+4O2--8e-═CO2+2H2O | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| D. | 当固体电解质中有1mol O2-通过时,电子转移2mol |
11.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | pH=12的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=1×10-14mol•L-1:K+、Na+、Cl-、NO3- |
8.信息、材料、能源被称为新科技革命的“三大支柱”.下列有关资讯错误的是( )
| A. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| B. | 中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源 | |
| C. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| D. | 结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体 |
15.下列有关实验的解释或说明正确的是( )
| A. | 为了加快过滤速度,可用减压过滤或边过滤边用玻璃棒搅拌 | |
| B. | 当沉淀的密度较大时,从液体分离出沉淀可用倾析法,它的优点是操作简单,速度快 | |
| C. | 为了减弱铜锌原电池中的极化现象,可在溶液中加入少量的双氧水 | |
| D. | 硝酸银是鉴别食盐和工业盐的最简单的试剂之一 |
5.有一无色溶液,可能含有K+、Ag+、Al3+、Mg2+、NH4+、Cl-、SO32-、SO42-、I-、Br-、HCO3-、AlO2-、MnO4-中的几种.为确定其成分,做如下实验:
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀;再加热,未见有气体放出;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;分液后,向水层加入BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀;再加热,未见有气体放出;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;分液后,向水层加入BaCl2溶液,有白色沉淀产生.下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
9.合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1mol、1mol、2mol、2mol,此时该反应由正反应方向开始建立平衡.
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
N2(g)+3H2(g)═2ΝΗ3(g)△H=-92.4kJ•mol-1.
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2kJ,
用H2表示的平均速率为0.15molL-1min-1或0.15mol/(Lmin).
(2)合成氨厂可用反应CO(g)+H2O(g)?H2(g)+CO2(g)获得H2,已知该反应的平衡
常数随温度的变化如表,试回答下列问题:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(选填“正”或“逆”).
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的最大转化率为75%.
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有d;
a.增加CO的用量 b.增加H2O(g)的用量c.增大压强 d.降低温度.
10.下列说法正确的是( )
| A. | 按系统命名法,CH3CH(C2H5)CH2CH(CH3)2的命名为:2-甲基-4-乙基戊烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. |  的单体是CH3-C=C-CH3和CH2=CH-CN 的单体是CH3-C=C-CH3和CH2=CH-CN | |
| D. | 已知 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 可使Br/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳酸双键 |
 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.