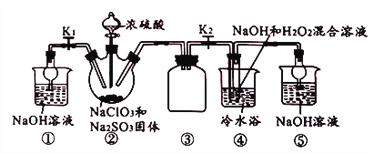
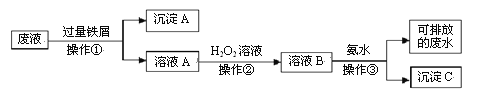
题目内容
【题目】温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )

A. T2>25℃ B. x=1.0×10﹣7
C. KW(a)=KW(d) D. b点溶液呈碱性,c点溶液呈酸性
【答案】C
【解析】A、水的电离吸热,升高温度,促进水的电离,25℃时纯水中c(H+)=1.0×10-7mol/L,T2时纯水中c(H+)=1.0×10-6mol/L,比25℃时纯水中c(H+)大,所以T2>25℃,故A正确;B、T1为常温,纯水中c(H+)=1.0×10-7mol/L,所以x=1.0×10-7,故B正确;C、升高温度,促进水的电离,水的离子积增大,T2>25℃,所以KW(a)<KW(d),故C错误;D、b点溶液中c(H+)>c(OH),溶液显酸性,c点溶液c(H+)<c(OH),溶液显碱性,故D正确。故选C。

【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
【答案】C
【解析】A、Ba(OH)2为强碱,抑制水的电离,Na2C03为强碱弱酸盐,CO32-结合水中的H+,从而促进水的电离,因此Na2C03溶液中水电离的c(OH)大,故A错误;B、溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),c(Na+)>c(Cl-),根据醋酸钠的物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以(Cl-)=c(CH3COOH),c(Na+)>c(Cl-)=c(CH3COOH),故B错误;D、①NH4HCO3中NH4+水解呈酸性,HCO3水解呈碱性,促进NH4+的水解;②NH4HSO4在水溶液中完全电离出H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解产生H+的浓度小,它对抑制NH4+的水解抑制程度小;④NH3H2O部分电离,产生的NH4+浓度比盐溶液中的小,故四种溶液中NH4+的浓度:②>③>①>④,故C正确;D、根据电荷守恒NaClO(aq)中c(Na+)+c(H+)=c(OH)+c(ClO),所以NaClO(aq)中离子总浓度为2[c(Na+)+c(H+)];根据电荷守恒NaCl(aq)中离子总浓度也为2[c(Na+)+c(H+)];等浓度的NaClO(aq)与NaCl(aq)中c(Na+)相同,NaClO溶液中ClO-水解,溶液呈碱性,c(OH)>c(H+),c(H+)<![]() ,而NaCl(aq)中,c(OH)=c(H+)=
,而NaCl(aq)中,c(OH)=c(H+)=![]() ,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
【题型】单选题
【结束】
17
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)