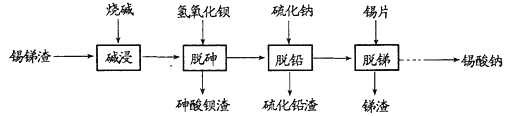
题目内容
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带 为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中), 得到海带灰悬浊液,然后按以下实验流程提取单质碘:
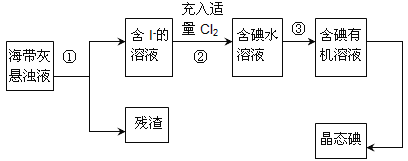
(1)指出提取碘的过程中有关的实验操作名称:①_______,③_______。
(2)操作③中所用的有机试剂可以是________(填序号)A.四氯化碳 B.乙醇,简述选择其理由________。
(3)操作过程③可以分解为如下几步:
A.检验分液漏斗活塞和上口的玻璃塞是否漏液;
B.把50mL碘水和15mL 有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
D.把盛有溶液的分液漏斗放在铁架台的铁圈中;
E.静置、分层。
F.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
G.旋开活塞,用烧杯接收下层溶液;
H.从分液漏斗上口倒出上层液体;
①上述F步操作的目的是:____;
②最后碘的有机溶液是通过_____获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置,指出其错误之处并加以改正_____。
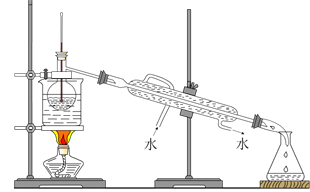
(5)进行上述蒸馏操作时,使用水浴的原因是 _______,最后晶态碘在________里聚集。
【答案】过滤 萃取分液 A 不溶于水且溶解碘的能力远大于水 平衡压强,便于液体流出 漏斗下口 未垫石棉网加热,应垫石棉网加热;温度计水银球插到了液面下,应该在支管口附近的位置;冷却水方向反了,应该是下口进上口出 易控制温度,使蒸馏烧瓶内液体受热均匀 蒸馏烧瓶
【解析】
以海带为原料获得少量碘单质:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘离子的溶液,向水溶液中通入适量Cl2,发生反应为2I-+Cl2=2Cl-+I2,向含有碘单质的水溶液中加入萃取剂,得到含碘有机溶液,最后蒸馏得到碘单质。据此分析解答。
(1)操作①是将溶液和不溶性固体分离,是过滤,操作③是从碘水中获取含碘有机溶液,可以采用萃取、分液的方法,故答案为:过滤;萃取、分液;
(2)碘在萃取剂中的溶解度要大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应,可以选择四氯化碳,不能选用乙醇,因为乙醇易溶于水,故答案为:A;四氯化碳不溶于水,且溶解碘的能力远大于水,乙醇易溶于水;
(3)①将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡压强,便于液体流出,故答案为:平衡压强,便于液体流出;
②分液漏斗中的下层液体从下口流出,上层液体从上口倒出,四氯化碳的密度大于水,含有碘单质的四氯化碳在下层,从漏斗下口放出,故答案为:漏斗下口;
(4)由图可知,烧杯底部表面积大,加热需要石棉网使其受热均匀;温度计的水银球应与烧瓶支管口相平,测蒸汽温度;冷却水应下进上出,故答案为:未垫石棉网加热,应垫石棉网加热;温度计水银球插到了液面下,应该在支管口附近的位置;冷却水方向反了,应该是下口进上口出;
(5)用酒精灯直接加热,温度变化快,而水浴加热,易于控制温度,能够使蒸馏烧瓶内溶液受热比较均匀;碘的沸点比四氯化碳高,最后碘在蒸馏烧瓶内聚集,故答案为:易控制温度,使蒸馏烧瓶内液体受热均匀;蒸馏烧瓶。

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案