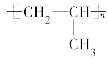题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.在密闭容器中,使1molN2和3molH2充分反应后生成NH3的分子数为2NA
B.标准状况下,0.56L丙烷中含有共价键的数目为0.2NA
C.2gH218O和D2O的混合物中,含有的中子数为NA
D.标准状况下1.12LNO2通入足量NaOH溶液中被完全吸收,转移电子数为NA
【答案】C
【解析】
A.N2与H2化合成NH3的反应为可逆反应,在密闭容器中1molN2和3molH2充分反应后生成NH3分子物质的量小于2mol,生成的NH3分子数小于2NA,A项错误;
B.n(C3H8)=![]() =0.025mol,1个丙烷分子中含2个C-C键和8个C-H键,标准状况下0.56L丙烷中含有的共价键物质的量为0.025mol×10=0.25mol,B项错误;
=0.025mol,1个丙烷分子中含2个C-C键和8个C-H键,标准状况下0.56L丙烷中含有的共价键物质的量为0.025mol×10=0.25mol,B项错误;
C.H218O和D2O的摩尔质量都是20g/mol,2gH218O和D2O混合物中分子物质的量为![]() =0.1mol,1个H218O分子和1个D2O分子中都含有10个中子,2gH218O和D2O混合物中含有中子物质的量为0.1mol×10=1mol,含有的中子数为NA,C项正确;
=0.1mol,1个H218O分子和1个D2O分子中都含有10个中子,2gH218O和D2O混合物中含有中子物质的量为0.1mol×10=1mol,含有的中子数为NA,C项正确;
D.二氧化氮与氢氧化钠反应的方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O,标准状况下1.12LNO2的物质的量是0.05mol,通入足量NaOH溶液中被完全吸收,转移电子数为0.025NA,D项错误;
答案选C。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2 (亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___(填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___。