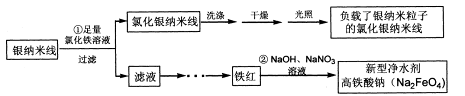
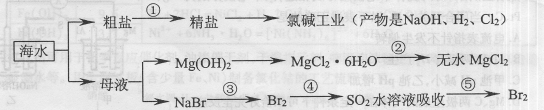
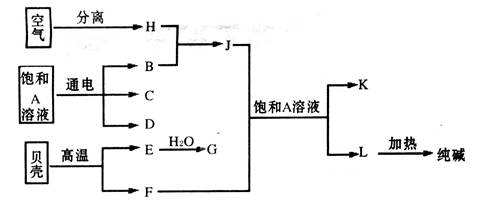
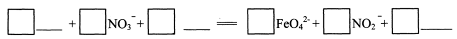题目内容
(10分)钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题:
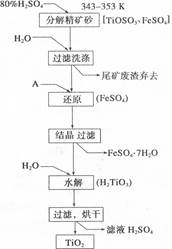
(1)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ;上述制备Ti02的过程中,所得到的副产物是 ,可回收利用的物质是:___________________。
(2)写出TiOS04溶液在加热条件下水解反应的离子方程式:
(3)为测定TiOS04的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3Ti02+ +Al+6H+==3Ti3++AL3++3H20。过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液作指示剂,用酸式滴定管滴加0.1mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30mL FeC13溶液。待测钛液中TiOS04的物质的量浓度是____________________。

(1)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ;上述制备Ti02的过程中,所得到的副产物是 ,可回收利用的物质是:___________________。
(2)写出TiOS04溶液在加热条件下水解反应的离子方程式:
(3)为测定TiOS04的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3Ti02+ +Al+6H+==3Ti3++AL3++3H20。过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液作指示剂,用酸式滴定管滴加0.1mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30mL FeC13溶液。待测钛液中TiOS04的物质的量浓度是____________________。
(10分)
(1)铁粉 FeSO4?7H2O H2SO4
(2)TiO2++2H2O=H2TiO3↓+2H+
(3)1.5 mol?L-1
(1)铁粉 FeSO4?7H2O H2SO4
(2)TiO2++2H2O=H2TiO3↓+2H+
(3)1.5 mol?L-1
(1)因Fe2+易被氧气氧化生成Fe3+,为防止Fe2+被氧化,物质A是铁粉,其反应原理为:2Fe3++ Fe=3Fe2+;同时不会引入新的杂质;
制备Ti02的过程中,所得到的副产物是:FeSO4?7H2O ;可回收利用的物质是:H2SO4;
(2)TiOS04溶液在加热条件下水解反应的离子方程式可由流程图得知,Ti以H2TiO3沉淀的形式出现,即方程式为:TiO2++2H2O=H2TiO3↓+2H+;
(3)反应的离子方程式为:Fe3++Ti3+=Fe2++Ti4+;Fe3+与Ti3+以1:1的形式反应, ,即20 mL滤液中
,即20 mL滤液中 ,由Ti元素守恒可知
,由Ti元素守恒可知 ,则100 mL滤液中
,则100 mL滤液中
待测钛液中TiOS04的物质的量浓度是
制备Ti02的过程中,所得到的副产物是:FeSO4?7H2O ;可回收利用的物质是:H2SO4;
(2)TiOS04溶液在加热条件下水解反应的离子方程式可由流程图得知,Ti以H2TiO3沉淀的形式出现,即方程式为:TiO2++2H2O=H2TiO3↓+2H+;
(3)反应的离子方程式为:Fe3++Ti3+=Fe2++Ti4+;Fe3+与Ti3+以1:1的形式反应,
 ,即20 mL滤液中
,即20 mL滤液中 ,由Ti元素守恒可知
,由Ti元素守恒可知 ,则100 mL滤液中
,则100 mL滤液中
待测钛液中TiOS04的物质的量浓度是


练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目