题目内容
【题目】已知有五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数都相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
(1)C两种元素的名称分别为________。
(2)用电子式表示离子化合物A2B的形成过程:_______________。
(3)写出D元素形成的单质的结构式:________________________。
(4)写出下列物质的电子式:
A、B、E形成的化合物:________________;D、E形成的化合物:__________________。
(5)A、B两种元素组成的化合物A2B2属于________(填“离子”或“共价”)化合物,存在的化学键类型是____________;写出A2B2与水反应的化学方程式:___________________________。
【答案】 硫 ![]()
![]()
![]()
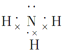 离子 离子键和共价键 2Na2O2+2H2O===4NaOH+O2↑
离子 离子键和共价键 2Na2O2+2H2O===4NaOH+O2↑
【解析】因为A2B中所有离子的电子数相同,在电子总数为30的A2B型化合物中,每个离子的电子数为10,所以可推知A是Na,B是O;因为4个原子核10个电子形成的分子中,每个原子平均不到3个电子,所以只能从原子序数为1~8的元素中寻找,则一定含有氢原子,分子中有4个原子核共10个电子,则一定为NH3;因为原子序数D>E,所以D为N,E为H。C与A(Na)同周期,与B(O)同主族,所以C位于第三周期第ⅥA族,为S。
(1)根据上述分析可知,C的元素名称为硫;(2)离子化合物A2B应为氧化钠,用电子式表示其形成过程:![]() ;(3)D元素为氮元素,单质为N2,N2中氮原子和氮原子之间以氮氮三键相结合。结构式为
;(3)D元素为氮元素,单质为N2,N2中氮原子和氮原子之间以氮氮三键相结合。结构式为![]() ;(4)A、B、E形成离子化合物氢氧化钠,电子式为
;(4)A、B、E形成离子化合物氢氧化钠,电子式为![]() ;D、E形成共价化合物氨气,电子式为
;D、E形成共价化合物氨气,电子式为 ;(5)A、B两种元素组成的化合物A2B2为过氧化钠,是离子化合物,其中即含有离子键,也含有共价键;过氧化钠与水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O===4NaOH+O2↑。
;(5)A、B两种元素组成的化合物A2B2为过氧化钠,是离子化合物,其中即含有离子键,也含有共价键;过氧化钠与水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O===4NaOH+O2↑。

【题目】从煤化工行业中可以得到许多重要的工业资源。回答下列问题:
(1)从煤的气化获得的化工原料气中含有的少量羰基硫(COS)会引起催化制中毒,大气污染等问题。
①羰基硫与烧碱溶液反应生成两种正盐的离子方程式为_________________________________。
②羰基硫的脱硫方法之一为COS(g)+H2(g)=H2S(g)+ CO(g) ΔH=+7kJ·mol-1,已知反应中部分物质的键能数据如下:
化学键 | C=O | C=S | H-S | H-H |
键能(kJ·mol-1) | 745 | 577 | 339 | 436 |
则CO分子中的碳氧键的键能为_________________。
(2)羰基硫在高温下发生水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g)。T℃时,将0.30 molCOS(g)与0.50mol H2O(g)充入10L的恒容密闭容器中,30 s后反应达到平衡状态,此时H2S的物质的量分数为0.30。
H2S(g)+CO2(g)。T℃时,将0.30 molCOS(g)与0.50mol H2O(g)充入10L的恒容密闭容器中,30 s后反应达到平衡状态,此时H2S的物质的量分数为0.30。
①0~30 s内,COS的平均反应速率v(COS)=___________,该反应的平衡常数K=__________(保留3位有效数字)。
②向反应容器中再分别充入下列气体,能使COS的转化率增大的是_________(填字母)。
A.COS B.H2O C.H2S D.CO2
(3)将含H2S尾气的空气按一定流速通入酸性FeCl3溶液中,可实现含H2S尾气的空气脱硫。在FeCl3 溶液吸收H2S的过程中,溶液中的n(Fe3+)及被吸收的n(H2S)随时间t的变化如图所示。

①由图中信息可知,0~t1时间段内,一定发生的反应是__________________________(用离子方程式表示)。
②t1时刻后,溶液中n(Fe3+)保持微量减少至基本不变,其原因是__________________________________。
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是( )
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 向1mLlmol·L-1MgCl2溶液中滴加2滴2mol·L-1NaOH溶液,生成白色沉淀;再滴加2滴1mol·L-1'FeCl3溶液,白色沉淀变成红褐色沉淀 | 3Mg(OH)2(s)+2Fe3+(aq) |
B | 比较HClO和CH3COOH的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
D | 检验某溶液中是否含有SO42- | 向该溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
A. A B. B C. C D. D