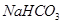��Ŀ����
��һ�̶��ݻ����ܱ������н������·�Ӧ�� ��ƽ�ⳣ��K���¶ȣ��Ĺ�ϵ���£�
��ƽ�ⳣ��K���¶ȣ��Ĺ�ϵ���£�
��1���÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ___________________��
��2���÷�Ӧ������ӦΪ__________������ȡ������ȡ�����Ӧ��
��3�����жϸ÷�Ӧ�Ƿ��Ѿ��ﵽ��ѧƽ��״̬����___________��
A��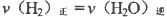 B�����������COŨ�Ȳ���
B�����������COŨ�Ȳ���
��4����850��ʱ�����淴Ӧ��
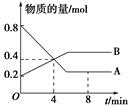
�ڸ������ڸ����ʵ�Ũ�ȱ仯���£�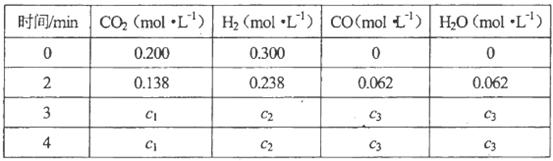
���㣺3min��4min�ﵽƽ��ʱ��CO��ƽ��Ũ��c3=________��CO2(g)��ת����a=________��
����10�֣���1��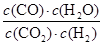 ��2�֣�
��2�֣�
��2�����ȣ�2�֣�
��3��AB��2�֣�
��4��0��120mol/L ��2�֣� 60%��2�֣�
���������������1������ƽ�ⳣ���Ķ���ø÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ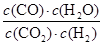
��2�����¶����ߣ�K��С��˵������ƽ�������ƶ�����������Ϊ���ȷ�Ӧ��
��3��A���ﵽ��ѧƽ��״̬ʱ��v��= v������H2��H2O�����ʵ���֮��Ϊ1:1����ȷ��B���ﵽ��ѧƽ��״̬ʱ�������ʵ�Ũ�Ȳ��䣬��ȷ����ѡAB��
��4��850��Cʱ��K=1��0������c3��c3=��0��2- c3������0��3- c3�������c3=0��12mol/L,CO2��ת����Ϊ0��12 mol/L��0��2 mol/L��100%=60%
���㣺���黯ѧƽ�ⳣ���Ķ��塢��ѧƽ����ƶ�����ѧƽ��״̬���жϡ���ѧƽ��ļ���

��ҵ�Ϻϳɰ��ķ�Ӧ��N2(g)��3H2(g)  2NH3(g)��H����92.60 kJ��mol��1��
2NH3(g)��H����92.60 kJ��mol��1��
��1���ھ��ȡ��ݻ��̶����ܱ������з�����Ӧ��N2(g)��3H2(g)  2NH3(g)������˵����˵��������Ӧ������Ӧ������е���________(�����)��
2NH3(g)������˵����˵��������Ӧ������Ӧ������е���________(�����)��
�ٵ�λʱ��������2n mol NH3��ͬʱ����3n mol H2
�ڵ�λʱ��������6n mol N��H����ͬʱ����2n mol H��H��
����N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
�ܻ�������ƽ��Ħ����������
�������ڵ������ܶȲ���
��2����֪�ϳɰ���Ӧ��ij�¶���2 L���ܱ������н��У�����������ݣ�
| ʱ��(h) ���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
���ݱ������ݼ��㣺
�ٷ�Ӧ���е�2 hʱ�ų�������Ϊ________ kJ��
��0��1 h��N2��ƽ����Ӧ����Ϊ________ mol��L��1��h��1��
�۴��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K��________(������λС��)��
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1.00 mol����ѧƽ�⽫��________�����ƶ�(�����Ӧ�����淴Ӧ��)��
úֱ��ȼ�յ����������ʽϵͣ�Ϊ����������ʣ���ҵ�Ͻ�ú����(ת���CO��H2)���ٺϳ��Ҵ��������ѵȶ�����Դ��
(1)��ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ������� ���������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⡣�õ�صĸ�����ӦʽΪ______________________��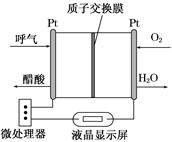
(2)ú����������������ڹ�ҵ�ϳɶ����ѣ��䷴Ӧ���£�
2CO(g)��4H2(g) CH3OCH3(g)��H2O(g)��
CH3OCH3(g)��H2O(g)��
ͬʱ��������Ӧ��CO(g)��2H2(g) CH3OH(g)��CO(g)��H2O(g)??CO2(g)��H2(g)��
CH3OH(g)��CO(g)��H2O(g)??CO2(g)��H2(g)��
���¶�Ϊ250 �桢ѹǿΪ3.0 MPaʱ��ij������Ͷ�ϱ�V(H2)��V(CO) ��a����������ƽ��ʱ��Ӧ��ϵ�и���ֵ�����������±���
| ���� | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
| ������� | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
��Ͷ�ϱ�a��________��
��250��ʱ��ӦCO(g)��H2O(g)
 CO2(g)��H2(g)��ƽ�ⳣ��K��________��
CO2(g)��H2(g)��ƽ�ⳣ��K��________�� ��һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��  2NH3��g����CO2��g��
2NH3��g����CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹ ǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ��/mol�� L��1 | 2.4�� 10��3 | 3.4�� 10��3 | 4.8�� 10��3 | 6.8�� 10��3 | 9.4�� 10��3 |
��1�������жϸ÷ֽⷴӦ�Ѿ��ﵽƽ�����________��
A��2v��NH3����v��CO2��
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���
D���ܱ������а����������������
��2�����ݱ������ݣ���ʽ����25.0 ��ʱ�ķֽⷴӦƽ�ⳣ����_______________��
��3��ȡһ�����İ�������粒������һ�����������ܱ���������У���25.0 ���´ﵽ�ֽ�ƽ�⡣���ں�����ѹ�������������������粒����������________������ӡ��������١����䡱����
 xC��g����2D��g������5min���D��Ũ��Ϊ0.5mol/L��c��A����c��B����3��5��C��ƽ����Ӧ����Ϊ0.1mol/��L��min������
xC��g����2D��g������5min���D��Ũ��Ϊ0.5mol/L��c��A����c��B����3��5��C��ƽ����Ӧ����Ϊ0.1mol/��L��min������ 2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��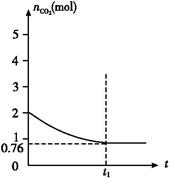
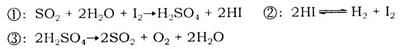
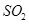 b��
b��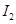 c��
c�� d��HI
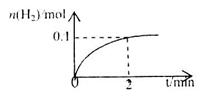
d��HI �����ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����
�����ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����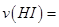 _________��
_________��
 b��
b��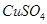 c��
c��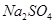 d��
d��