题目内容
【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。
【答案】ⅣA S NaOH 2Na+Cl2![]() 2NaCl
2NaCl
【解析】
由元素所在周期表中的位置,可确定①为C、②为O、③为Na、④为Al、⑤为S、⑥为Cl。比较原子半径和金属性时,依据同周期元素从左往右,原子半径依次减小,金属性依次减弱;同主族元素从上到下,原子半径依次增大,金属性依次增强的递变规律。
(1)由以上分析知,①为C,电子排布为2、4,所以它在周期表中的位置是第二周期ⅣA族。答案为:ⅣA;
(2) ②为O、⑤为S,两种元素位于同主族,S在O的下方,则原子半径较大的是S。③为Na、④为Al,两种元素都位于第三周期,Na在Al的左边,金属性Na>Al,所以它们的最高价氧化物对应水化物中碱性较强的是NaOH。答案为:S;NaOH;
(3)③为Na、⑥为Cl,钠在Cl2中燃烧生成NaCl,化学方程式为2Na+Cl2![]() 2NaCl。答案为:2Na+Cl2
2NaCl。答案为:2Na+Cl2![]() 2NaCl。
2NaCl。

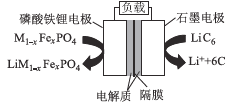
【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
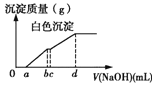
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。
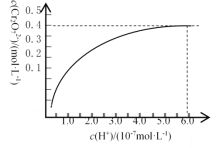
②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
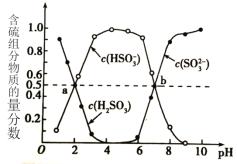
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。
已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。