题目内容
【题目】用50mL 0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH 溶液反应测定中和热。下图装置不妥之处是_______,应如何改正____________,NaOH的量要比HCl多一些的原因是____________。
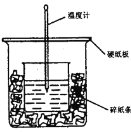
【答案】无环形玻璃搅拌棒、硬纸板; 增加环形玻璃搅拌棒、把硬纸板换成泡沫塑料板; 使HCl尽可能与NaOH反应而避免与![]() 反应,实验数据更准确。
反应,实验数据更准确。
【解析】
测定中和热应在最短时间内让盐酸与氢氧化钠充分反应,所以应增添搅拌装置;为了测得温度的最高值,应加强保温、隔热和防止热量散失。
①装置不妥之处:无环形玻璃搅拌棒、小烧杯口与大烧杯口未相平、硬纸板隔热效果不佳;
②改正措施:增加环形玻璃搅拌棒、在大小烧杯间填满碎纸条使小烧杯口与大烧杯口相平、把硬纸板更换成泡沫塑料板;
③NaOH过量的原因:NaOH中必然混有![]() ,会导致一部分盐酸与
,会导致一部分盐酸与![]() 反应,故测得的中和热不准确,过量的NaOH是为了HCl尽可能与NaOH反应而避免与
反应,故测得的中和热不准确,过量的NaOH是为了HCl尽可能与NaOH反应而避免与![]() 反应,使实验数据更准确。
反应,使实验数据更准确。

【题目】利用催化技术可将汽车尾气中的 NO 和 CO 转变成 CO2 和 N2,化学方程式:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入 NO 和 CO,测得不同时间的 NO 和 CO 的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-3mol/L | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
下列说法中不正确的是( )
A. 2 s 内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1
B. 在该温度下,反应的平衡常数 K=5
C. 若将容积缩小为原来的一半,NO 转化率大于 90%
D. 使用催化剂可以提高单位时间内 CO 和 NO 的处理量
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
【题目】下表为元素周期表一部分,针对表中①~⑥元素,回答下列问题
① | ② | ||||||||||||||
③ | ④ | ⑤ | ⑥ |
(1)①元素在周期表中的位置是第二周期 ________ 族。
(2)②和⑤两种元素中原子半径较大的是 _________(填元素符号)。③和④两种元素的最高价氧化物对应水化物中碱性较强的是___(填化学式)。
(3)写出③的单质在⑥单质中燃烧的化学方程式______。