题目内容
【题目】铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________,其原因是_____________________。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________(填晶体类型)。
(4)金属铁晶体中原子采用_________堆积,铁晶体的空间利用率为______(用含π的式子表示)。
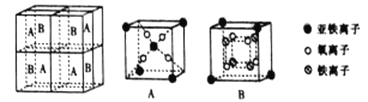
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________(填最简整数比);已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为_______________nm(用含d和NA的代数式表示)。
【答案】 3d64s2 N 氮原子2p轨道上的电子半充满,相对稳定,更不易失去电子 12NA 5 分子晶体 体心立方 ![]() π 1∶2∶4
π 1∶2∶4 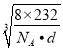 ×102
×102
【解析】(1)基态铁原子的价电子排布式为: 3d64s2
(2)①C、N、O的第一电离能随核电荷数递增呈增大趋势,因N的2p轨道为半充满结构,更不易失去电子,第一电离相对较大,则C、N、O的第一电离最大的为N;
②在配合物![]() 中,
中,![]() 与铁离子之间有6个配位键,在每个
与铁离子之间有6个配位键,在每个![]() 内部有一个σ键,所以
内部有一个σ键,所以![]() 该配合物中含有
该配合物中含有![]() 键的数目为
键的数目为![]() 个或
个或![]() ,
,
(3)配合物![]() 的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,
的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,![]() ,
,![]() ,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体, 因此,本题正确答案是:5;分子晶体;
,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体, 因此,本题正确答案是:5;分子晶体;
(4)金属铁晶体原子采用体心立方堆积.铁晶体的晶胞含有2个铁原子,设晶胞边长为a,金属原子半径为r,则面对角线长![]() a,体对角线长
a,体对角线长![]() a=4r,空间利用率=
a=4r,空间利用率=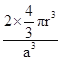 =
=![]() 。
。
(5)A含有1.5个亚铁离子、4个氧离子,B含有0.5个亚铁离子、4个氧离子、4个铁离子,则该氧化物中Fe2+、Fe3+、O2-的个数比为1:2:4。
晶胞含有Fe2+、Fe3+、O2-的个数分别是为4、8、16,它们的相对质量之和是8×232,根据m=ρV可得8×232 g=d×g/cm3a3×NA,a =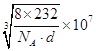 nm。
nm。

 走进文言文系列答案
走进文言文系列答案【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D