题目内容
科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
(1)稀硫酸和铁粉
(2)杀菌剂(强氧化剂)和吸附剂(净水剂)
(3)Zn+2OH--2e-=Zn(OH)2变小
(4)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-218 kJ/mol
(2)杀菌剂(强氧化剂)和吸附剂(净水剂)
(3)Zn+2OH--2e-=Zn(OH)2变小
(4)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-218 kJ/mol
(1)FeSO4是强酸弱碱盐,易发生水解使溶液呈酸性,配制溶液时,需加入稀硫酸抑制Fe2+水解,FeSO4具有较强的还原性,还需加入铁粉,防止Fe2+被氧化。
(2)高铁酸钾中铁为+6价,具有很强的氧化性,可用于杀菌,高铁酸钾的还原产物是Fe3+,易水解生成氢氧化铁胶体,具有较强的吸附杂质的能力,可用于净水。
(3)该电池放电时,Zn失电子,为电池的负极,结合产物Zn(OH)2,可写出放电时的负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-。充电时,充电电池的阳极与电源的正极相连,阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O,pH变小。
(4)根据反应FeO(s)+CO(g)=Fe(s)+CO2(g)与高炉炼铁的反应可知:3×①-②-2×③得到6FeO(s)+6CO(g)=6Fe(s)+6CO2(g) ΔH=-1 308 kJ/mol,简化成FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-218 kJ/mol。
(2)高铁酸钾中铁为+6价,具有很强的氧化性,可用于杀菌,高铁酸钾的还原产物是Fe3+,易水解生成氢氧化铁胶体,具有较强的吸附杂质的能力,可用于净水。
(3)该电池放电时,Zn失电子,为电池的负极,结合产物Zn(OH)2,可写出放电时的负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-。充电时,充电电池的阳极与电源的正极相连,阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O,pH变小。
(4)根据反应FeO(s)+CO(g)=Fe(s)+CO2(g)与高炉炼铁的反应可知:3×①-②-2×③得到6FeO(s)+6CO(g)=6Fe(s)+6CO2(g) ΔH=-1 308 kJ/mol,简化成FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-218 kJ/mol。

练习册系列答案
相关题目
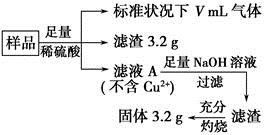


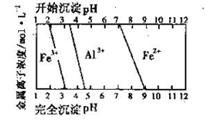

 FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。 Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
