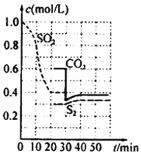
题目内容
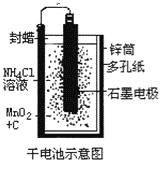
【题目】普通锌锰干电池的简图(下图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽。在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池负极的电极反应式为:2MnO2+2NH4++2e-= Mn2O3+2NH3+H2O
C.该电池碳棒可用铜棒代替,但是工作电压会下降
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g
【答案】C
【解析】
A、一次电池不能重复使用,二次电池能重复使用,干电池是一次电池,所以当该电池电压逐渐下降后,不能利用电解原理能重新充电复原,故A错误;
B、根据原电池工作原理,负极应是失电子的,Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+,故B错误;
C、两极金属性差别越大,电压越大,铜是金属,碳是非金属,因此碳棒换成铜棒,电压会降低,故C正确;
D、根据选项B的电极反应式,每通过0.1mol电子消耗锌的质量是65×0.1/2g=3.25g,故D错误。
答案选C。

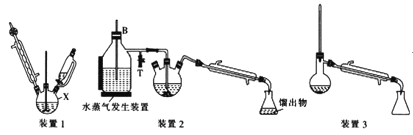
【题目】苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4![]() +9Fe+4H2O
+9Fe+4H2O![]() 4
4![]() +3Fe3O4
+3Fe3O4
已知部分有机物的一些数据如下表:
名称 | 密度(gmL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__。
(2)仪器X的名称是__;加入硝基苯时,“逐滴加入span>”的目的是__。
(3)分离提纯过程中加入NaCl固体的作用是__。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__;装置2中长导管B的作用是__。
(5)萃取分液操作过程中要远离明火和热源,原因是__。
(6)温度T的范围为__,实验结束得到6.0mL产物,则苯胺的产率为__(保留三位有效数字)。