题目内容
【题目】过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
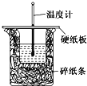
I.过氧化钙的制备。流程如下,步骤②的装置示意图为图一:
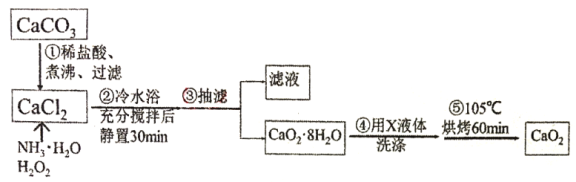

(1)步骤①将溶液煮沸、过滤。将溶液煮沸的目的是___。
(2)图一装置中:①仪器a的名称是___;
②反应的化学方程式为___;
③该反应需要在冷水浴中进行,原因是___。
(3)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是___。
Ⅱ.过氧化钙的测定:已知CaO2在350℃时迅速分解生成CaO和O2。该小组采用如图二所示装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
(1)量气管读数时需注意的项有:①气体冷却到室温;②量气装置两侧液面相平;③___。
(2)使用电子天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中CaO2的质量分数为___(保留3位有效数字)。
【答案】除去溶液中的CO2,防止加入氨水后形成碳酸钙,影响产物纯度 恒压滴液漏斗 CaCl2+2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4Cl 防止双氧水分解和浓氨水挥发,且有利于产品析出 去除结晶表面的水份 视线与凹液面最低处相平 43.2%或0.432
【解析】
反应①是碳酸钙和稀盐酸混合,至固体完全溶解,并将溶液煮沸,除去溶液中溶解的CO2,过滤除去不溶物后,所得含CaCl2的滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过滤得到过氧化钙晶体,水洗、乙醇洗、烘烤得到过氧化钙固体,据此分析解题;
I.(1)步骤①将溶液煮沸、过滤,将溶液煮沸的目的是除去溶液中的CO2,防止加入氨水后形成碳酸钙,影响产物纯度;
(2)①仪器a的名称是恒压滴液漏斗;
②反应中反应物为CaCl2、H2O2、NH3H2O,产物为CaO28H2O↓,还应该生成NH4Cl,则发生反应的化学方程式为CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl;
③H2O2和浓氨水受热均易分解,则该反应在冷水溶中进行,可防止双氧水分解和浓氨水挥发,且有利于产品析出;
(3)乙醇易挥发,而CaO2不溶于乙醇,用无水乙醇洗涤,去除结晶表面的水份;
Ⅱ.(1)为保证准确测定气体的气体,确保氧气的状态与环境温度和压强相同,使用量气管读数时需将气体冷却到室温并保证量气装置两侧液面相平,同时读数时还需要视线与凹液面最低处相平;
(2)CaO2在350℃时能迅速分解,生成CaO和O2,反应为2CaO2![]() 2CaO+O2↑,0.5000g样品置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,即反应产生的O2的物质的量为n(O2)=
2CaO+O2↑,0.5000g样品置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,即反应产生的O2的物质的量为n(O2)=![]() =0.0015mol,根据方程式,则样品中含有0.003mol的CaO2,则样品中CaO2的质量分数为w=
=0.0015mol,根据方程式,则样品中含有0.003mol的CaO2,则样品中CaO2的质量分数为w=![]() ×100%=43.2%。
×100%=43.2%。